СанПин для детских садов – основные нормы
Родители часто обнаруживают несоблюдение санитарных норм в детских садах. Не все знают, куда следует обращаться в этом случае, чтобы защитить своего ребенка. Нужно узнать, какой СанПин для детских садов действует, чтобы можно было контролировать выполнение этих правил. В нем указаны нормы, позволяющие организовать комфортное пребывание детей.
Основы
СанПин – документ, включающий основные санитарные и гигиенические нормы, утвержденные государством. Он используется и для дошкольных учреждений. СанПин 2.4.1.3049-13 включает правила наполнения коллективов, а также нормы о микроклимате, освещении, питании и прочих аспектах. В нашей стране сейчас используется документ, принятый в 2013 году. В 2017 году были внесены некоторые изменения.
В каждом дошкольном учреждении должны выполняться эти нормы, какая бы правовая форма у них ни была. Но эти правила не относятся к тем группам, которые находятся в квартирах или домах.
В детские сады можно зачислять детей от 0,2 до 7 лет. Наполнение групп устанавливается на основе площади помещения, где будут находиться малыши. Для каждого возраста действуют свои правила:
- До 3 лет на каждого ребенка выделяется от 2,5 кв. м.;
- От 3 до 7 лет предоставляется от 2 кв. м.
Расчет выполняется по количеству детей, которые будут находиться в группе. Если будет соблюдаться СанПин 2.4.1.3049-13, то для ребят в саду будет безопасная обстановка.
По новым нормам в помещении должно быть 21 градус. В комнате для сна этот показатель равен 18 градусам. В помещении для игр температура равна 24 градусам. Влажность должна быть не меньше 60 градусов.
Режим дня
Новый СанПин для детских садов включает нормы о распорядке дня. Время бодрствования детей 3-7 лет должно быть не больше 6 часов. Ребятам до 3 лет правила утверждаются на основе медицинских результатов. На протяжении дня прогулки должны длиться 3-4 часа: их проводят до обеда и после него. Для каждого возраста есть своя длительность сна. Ее средний показатель равен 12 часов в сутки, из которых 2,5 часа тратится на дневной отдых.
Время бодрствования детей 3-7 лет должно быть не больше 6 часов. Ребятам до 3 лет правила утверждаются на основе медицинских результатов. На протяжении дня прогулки должны длиться 3-4 часа: их проводят до обеда и после него. Для каждого возраста есть своя длительность сна. Ее средний показатель равен 12 часов в сутки, из которых 2,5 часа тратится на дневной отдых.
В группе на самостоятельную работу у детей должно уходить не меньше 4 часов. В это время входят игры, подготовка к школе, гигиена. Эти нормы относятся к возрасту 3-7 лет. Для малышей 1,5-3 года этот показатель не должен быть выше 10 минут. Образовательная работа ребят тоже обозначена в СанПине 2.4.1.3049-13. Занятия должны выполняться в течение всего дня. Следует учитывать, что для образовательной работы необходимая высокая активность и напряжением ума, поэтому ее лучше выполнять до обеда.
Нормы, указанные по отношению к прогулкам, являются рекомендациями. Они выполняются на основе погоды, которая в каждом регионе разная.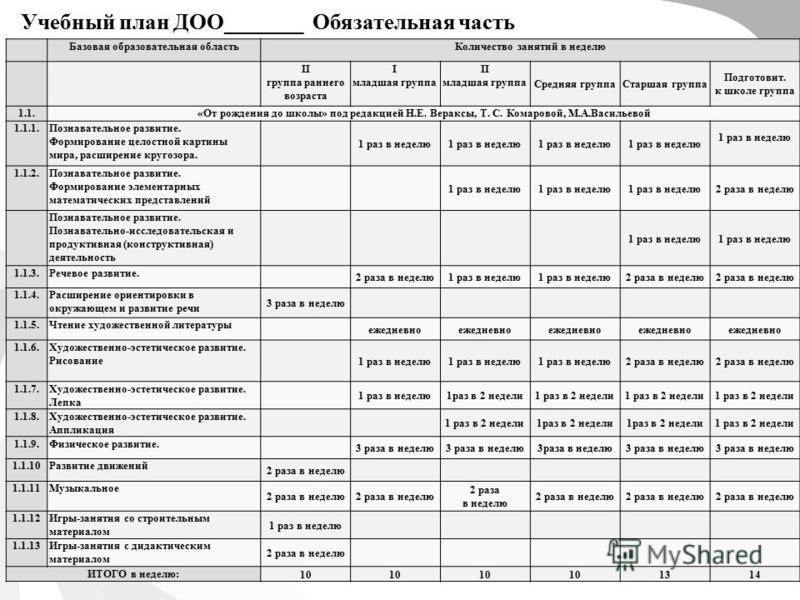 Если соблюдать правила по прогулке, то обеспечивается потребность движения за день. В детском садике должны использоваться следующие виды активной нагрузки:
Если соблюдать правила по прогулке, то обеспечивается потребность движения за день. В детском садике должны использоваться следующие виды активной нагрузки:
- Гимнастика;
- Физкультура;
- Физкультурные минутки;
- Игры;
- Ритмика;
- Занятия;
- Тренажеры;
- Плавание.
Детям 5-7 лет необходима физическая нагрузка на протяжении 8 часов в неделю. Обязательно должны выполняться мероприятия по закаливанию – проветривание помещений, умывание прохладной водой, занятия на свежем воздухе. Время для посещения бассейна отличается в зависимости от возраста. После этого только спустя 50 минут детей можно отправлять на прогулку.
Питание
Меню тоже прописано в СанПине. Нормы действуют во всех садах. Подаются все блюда в теплом виде. Есть график, по которому надо закладывать пищу в котел для приготовления. Повара используют продукты в установленном количестве.
Контроль за питанием осуществляется заведующей. Свежесть блюд тоже тщательно проверяется. Детям обязательно предоставляется 2 завтрака, обед, полдник. Питание утверждается по нормам калорий. Рацион у дошкольников сбалансированный. К необходимым продуктам относят:
Детям обязательно предоставляется 2 завтрака, обед, полдник. Питание утверждается по нормам калорий. Рацион у дошкольников сбалансированный. К необходимым продуктам относят:
- Мясо;
- Рыбу;
- Молоко;
- Яйца;
- Овощи;
- Фрукты.
На завтрак обычно дают молочную кашу, бутерброд с сыром, маслом. Из напитков присутствует чай или какао. На второй завтрак может быть фрукт или сок. В обед положено давать мясной суп, второе блюдо с салатом, компот или сок. На полдник предоставляется хлебобулочное изделие и кисломолочный напиток.
Особенности обработки
По СанПину 2.4.1.3049-13 в группе обязательно должно быть частое проветривание, когда дети не находятся в помещении. Сколько это длится, определяется температурой и отоплением. За 30 минут до прихода ребят надо закрыть окна. В теплый период проветривание можно выполнять и с детьми, но следует исключать сквозняки.
По новому СанПину 2.4.1.3049-13 кварцевание групп обязательно выполняется 2 раза в день, а потом проветривать. Необходимо мытье игрушек в детском саду каждый день, когда детей забрали домой. В младших группах это осуществляется 2 раза. Игрушки для улицы обрабатывают после возвращения в группу. Обязательно мытье только купленных изделий. Применяется мыльный раствор и чистая вода для ополаскивания. Моющее вещество должно быть безопасное.
По СанПину для детских садов должна выполняться замена постельного белья, когда оно загрязняется, но не меньше 1 раза в неделю. Стирка выполняется в прачечной или в отдельной организации, которая сотрудничает с садом по договору.
По санитарным нормам в группе для ребят должны быть индивидуальные горшки. А для детей 5 лет на унитазы крепят седушки. Горшки после использования обрабатывают с дезинфицирующими веществами. Унитазы моются не меньше 2 раз в день.
Пищеблок
В группах устанавливаются мойки, в которых обрабатывается посуда и все остальное. Обязательна подача горячей, холодной воды. Все емкости обрабатываются губкой, горчицей и содой. Потом ее моют водой, температура которой 50 градусов. Ополаскивается посуда водой в 70 градусов. А сушка происходит на специальной решетке. Каждый день посуда должна кипятиться. Это необходимо для соблюдения чистоты.
При обнаружении признаков заболевания, которое переходит через продукты, то посуда обрабатывается раствором хлорамина. Ее обязательно ополаскивают и высушивают. Все емкости маркируют на основе СанПина 2.4.1.3049-13. На них обозначается наименование блюда, которое наносится с помощью масляной краски.
Витаминизация осуществляется на основе состояния детей. Мероприятие контролируется медработниками. Об этом следует знать родителям. Если в рационе отсутствуют витаминизированные напитки, то витамины должны быть в третьих блюдах – компоте, киселе.
Если в рационе отсутствуют витаминизированные напитки, то витамины должны быть в третьих блюдах – компоте, киселе.
Помещения и оборудование
В СанПине с изменениями указано, какие комнаты могут быть около бассейна, а также чем их оборудуют. Есть требования и к работникам. Важное значение надо уделять уборке и дезинфекции этого помещения. Если циркуляция хорошая, заменять воду следует на протяжении 8 часов. Если такой функции нет, то слив выполняется каждый день. Очистка емкости проводится специальными сотрудниками. Ежедневно требуется мытье душевых, туалетов, раздевалок. Каждый месяц проводится генеральная уборка. Следить за качеством воды надо ежесуточно.
Для детского сада необходимо разделение игровых площадок от хозяйственных территорий. Запрещено сажать ядовитые деревья и кустарники. У детей должна быть соответствующая возрасту мебель. Все изделия обязательно маркируются.
Уборка
Помещения должны содержаться в чистоте, поэтому каждый день выполняется уборка. Она включает мытье полов, обработку мебели, устранение пыли. Везде устраняется пыль, в том числе за кроватями, шкафами, на дверях. Выполняются и еженедельные обработки.
Она включает мытье полов, обработку мебели, устранение пыли. Везде устраняется пыль, в том числе за кроватями, шкафами, на дверях. Выполняются и еженедельные обработки.
Окна обрабатывают каждую декаду. Столы для питания и занятий моют и протирают каждый день. Регулярно меняется столовое и постельное белье, халаты, полотенца, салфетки. Все грязное хранят в подсобных помещениях до отправления в стирку. Постельные принадлежности проветриваются на воздухе 2 раза в месяц.
Умывальные комнаты должны быть в чистоте. Полы в них моются регулярно. Обработке подлежат унитазы, горшки, сидения, умывальники. Для этого применяются специальные дезинфицирующие средства. Взрослые не должны пользоваться детскими уборными. Раздевалки тоже содержат в чистоте с помощью уборок.
Дети и взрослые перед входом в основное помещение снимают верхнюю одежду и переобуваются. Это нужно для поддержания чистоты в детском саду. Каждый вид работы выполняется регулярно.
Канализация
Водоснабжение и канализация работает от центральной магистрали.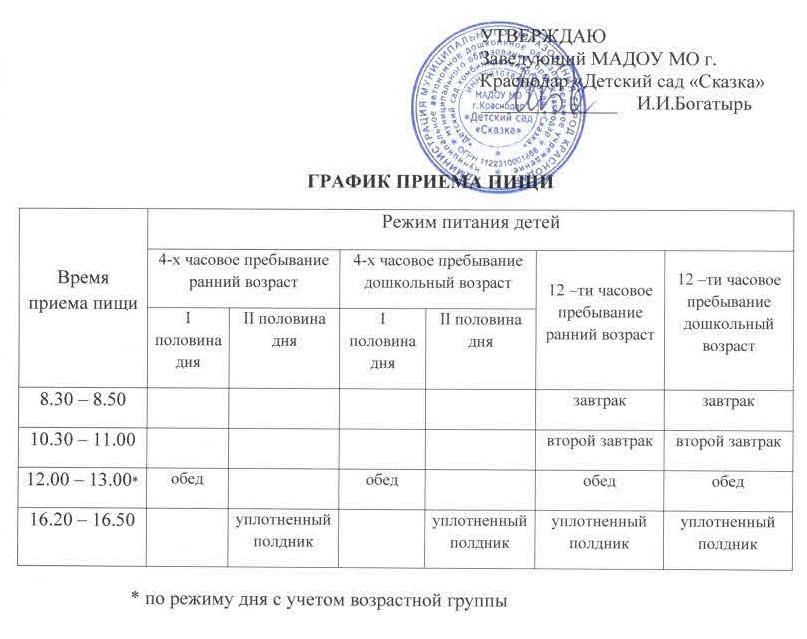 Если ее нет, то нужны устройства местных водопроводов и канализаций. Вода должна соответствовать ГОСТу 2874-54. Если такие устройства установить нельзя, то применяются колодцы. Они должны соответствовать санитарным требованиям.
Если ее нет, то нужны устройства местных водопроводов и канализаций. Вода должна соответствовать ГОСТу 2874-54. Если такие устройства установить нельзя, то применяются колодцы. Они должны соответствовать санитарным требованиям.
В местной канализации сточные воды обязательно очищаются. В качестве способа обработки выбираются почвенные варианты: полная фильтрация и орошение. Местная канализация может быть заменена люфт-клозетами.
Требования к сотрудникам
Ни одной сотруднице нельзя приступать к работе без медицинского осмотра, прохождения аттестации по знаниям норм санитарии. Потом выполняется проверка каждые 2 года, а подтверждается это тестированием.
Медсестра должна иметь медицинское среднее образование и опыт от 3 лет. Наличие медкнижки необходимо. Эти работники проходят осмотр через 3 месяца. При выполнении обязанностей используются нормы инструкции.
Младший воспитатель должен проводить мероприятия развлекательного типа вместе с воспитателем.
В его обязанности выходит обеспечение внутреннего распорядка и режима. Ему необходимо знать санитарные нормы и основы воспитания детей. Работника знакомят с технологической картой блюд.
Министерством образования созданы нормы, которым должен соответствовать каждый педагог. Он обязан планировать, организовывать досуг детей. Воспитателю нужно выполнять повседневную работу по реабилитации дошкольников. Он задействует педагогические технологии, которые позволяют проводить интересные занятия.
По советам психолога, личным наблюдениям, воспитатель работает с детьми в группе и индивидуально. Обязательна коррекционно-развивающая деятельность. Медицинские работники помогают ему реализовывать мероприятия для улучшения здоровья ребят. Также проводятся занятия для восстановления психофизического состояния. Воспитателю, так же как и другим сотрудникам, нужно соблюдать законы страны.
Заведующий детского сада должен руководить учреждением на основе законодательных норм. Он же обеспечивает хозяйственную и педагогическую деятельность. В его обязанности входит контроль за исполнением законных требований. Заведующий работает с детьми, создает условия для их комфортного пребывания в саду. Он обязательно контактирует с родителями. Заведующему надо контролировать проведение мероприятий по оздоровлению. Руководитель подбирает сотрудников, представляет детский сад другим организациям и следить за выполнением правил безопасности. Конкретные обязанности определяются работой учреждения.
Соблюдение норм СанПина считается обязанностью сотрудников детского сада. Если были выявлены какие-либо нарушения, родители могут обращаться с претензией. Сначала можно написать жалобу к руководству. Если меры ни были предприняты, то нужно обращаться в Роспотребнадзор. Организация выполнит проверку на соответствие нормам. Выявленные нарушения будут устранены. По некоторых жалобам приходится обращаться в прокуратуру или суд, если нарушение нанесло существенный вред здоровью. Соблюдением норм СанПина позволяет обеспечить детям комфорт, что необходимо для их нормального развития.
Соблюдением норм СанПина позволяет обеспечить детям комфорт, что необходимо для их нормального развития.
Требования, предъявляемые к детским дошкольным учреждениям
Требования, предъявляемые к детским дошкольным учреждениям
Вот и начался новый учебный год… Малыши вновь стали посещать детские сады. И многие родители волнуются, соответствуют ли санитарно-эпидемиологическим требованиям школы или дошкольные образовательные организации. Ранее, на страницах нашего сайта, мы уже писали о гигиенических требованиях, предъявляемых к режиму образовательного процесса в школах, теперь же хотим обратить Ваше внимание на гигиенические требования, предъявляемые к детским садам.
Во всех помещениях детского сада должна быть комфортная температура и достаточная освещенность. В детском саду на должно быть посторонних запахов.
Все помещения дошкольной организации должны ежедневно проветриваться. Проветривание проводится не менее 10 минут через каждые 1,5 часа.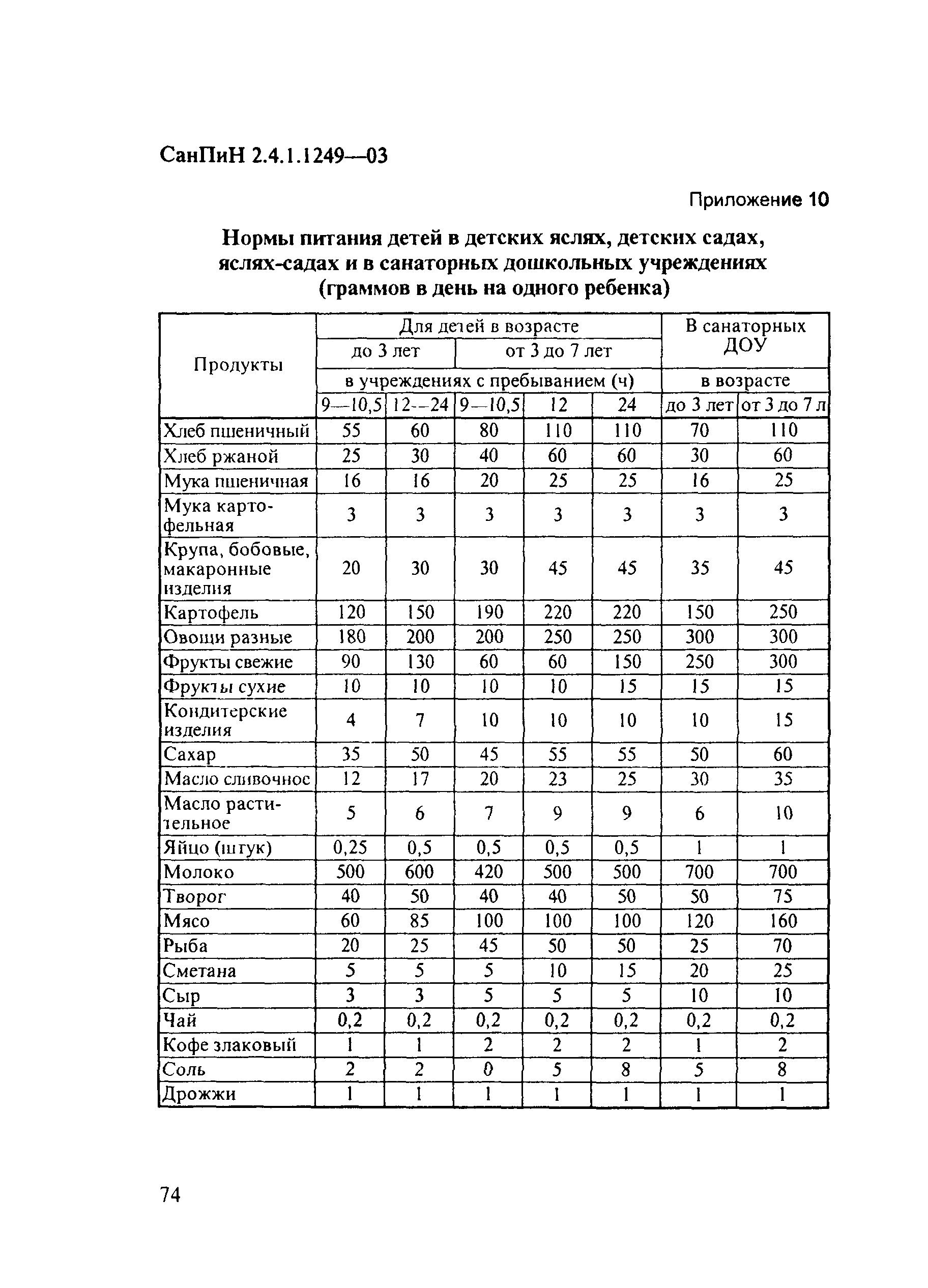 Сквозное проветривание в присутствии детей не проводится. Проветривание через туалетные комнаты не допускается. В присутствии детей допускается широкая односторонняя аэрация всех помещений в теплое время года.
Сквозное проветривание в присутствии детей не проводится. Проветривание через туалетные комнаты не допускается. В присутствии детей допускается широкая односторонняя аэрация всех помещений в теплое время года.
Длительность проветривания зависит от температуры наружного воздуха, направления ветра, эффективности отопительной системы. Проветривание проводится в отсутствие детей и заканчивается за 30 минут до их прихода с прогулки или занятий.
В помещениях спален сквозное проветривание проводится до дневного сна.
Контроль за температурой воздуха во всех основных помещениях пребывания детей осуществляется с помощью бытовых термометров.
Игровое оборудование, мебель, должны соответствовать возрасту детей и быть изготовлены из материалов, не оказывающих вредного воздействия на ребенка и предусматривающих возможность проведения влажной уборки с применением дезинфицирующих средств.
Стены помещений должны быть гладкими, без признаков поражений грибком и иметь отделку, допускающую влажную уборку с применением дезинфицирующих средств.
Раздевальные оборудуются шкафами для верхней одежды детей и персонала.
Стулья и столы должны быть одной группы мебели и промаркированы. Подбор мебели для детей проводится с учетом роста детей .
Основные размеры столов и стульев для детей раннего возраста и дошкольного возраста
В дошкольных образовательных организациях должно быть организовано отдельное помещение, с установкой кроватей, для сна детей.
Допускается использовать групповую комнату для организации сна детей с использованием выдвижных кроватей или раскладных кроватей с жестким ложем.
Количество детей в группах дошкольной образовательной организации общеразвивающей направленности определяется исходя из расчета площади групповой (игровой) комнаты – для групп раннего возраста (до 3 лет) не менее 2,5 метра квадратного на 1 ребенка и для дошкольного возраста (от 3 до 7 лет) – не менее 2,0 метра квадратного на одного ребенка.
Детская туалетная должна быть обеспечена персональными горшками для каждого ребенка, фактически находящегося в группе, дошкольной образовательной организации, а для детей в возрасте 5-7 лет персональными сиденьями на унитаз, изготовленными из материалов, безвредных для здоровья детей, допускающих их обработку моющими и дезинфекционными средствами, или одноразовыми сиденьями на унитаз.
В туалетных помещениях (рядом с умывальниками или напротив них) устанавливаются вешалки для детских полотенец (отдельно для рук и для ног) по списочному составу детей, хозяйственный шкаф. Допускается использование одноразовых полотенец для рук в туалетных для детей. Уборочный инвентарь должен храниться вне туалетных комнат.
Для каждой группы детского сада должна быть предусмотрена уличная групповая площадка.
Для защиты детей от солнца и осадков на территории каждой групповой площадки устанавливают теневой навес.
Ежегодно, в весенний период, на игровых площадках проводится полная смена песка. Песочницы в отсутствие детей необходимо закрывать во избежание загрязнения песка (крышками, полимерными пленками или другими защитными приспособлениями).
Рекомендуемая продолжительность ежедневных прогулок составляет 3-4 часа. Продолжительность прогулки определяется дошкольной образовательной организацией в зависимости от климатических условий. При температуре воздуха ниже минус 15°С и скорости ветра более 7 м/с продолжительность прогулки рекомендуется сокращать.
Рекомендуется организовывать прогулки 2 раза в день: в первую половину дня и во вторую половину дня – после дневного сна или перед уходом детей домой.
Ежедневный утренний прием детей проводится воспитателями и (или) медицинскими работниками, которые опрашивают родителей о состоянии здоровья детей. По показаниям (при наличии катаральных явлений, явлений интоксикации) ребенку проводится термометрия.
Выявленные больные дети или дети с подозрением на заболевание в дошкольные образовательные организации не принимаются; заболевших в течение дня детей изолируют от здоровых детей (временно размещают в помещениях медицинского блока) до прихода родителей или их госпитализации в лечебно-профилактическую организацию с информированием родителей.
После перенесенного заболевания, а также отсутствия более 5 дней (за исключением выходных и праздничных дней) детей принимают в дошкольные образовательные организации только при наличии справки с указанием диагноза, длительности заболевания, сведений об отсутствии контакта с инфекционными больными.
При организации режима пребывания детей в дошкольных образовательных организациях (группах) более 5 часов организуется прием пищи с интервалом 3-4 часа и дневной сон; при организации режима пребывания детей до 5 часов – организуется однократный прием пищи.
На самостоятельную деятельность детей 3-7 лет (игры, подготовка к образовательной деятельности, личная гигиена) в режиме дня должно отводиться не менее 3-4 часов.
Образовательную деятельность, требующую повышенной познавательной активности и умственного напряжения детей, следует организовывать в первую половину дня. Для профилактики утомления детей рекомендуется проводить физкультурные, музыкальные занятия, ритмику и т.п.
Занятия по физическому развитию основной образовательной программы для детей в возрасте от 3 до 7 лет организуются не менее 3 раз в неделю. Длительность занятий по физическому развитию зависит от возраста детей и составляет:
в младшей группе – 15 мин.,
в средней группе – 20 мин.
 ,
,в старшей группе – 25 мин.,
в подготовительной группе – 30 мин.
Один раз в неделю для детей 5-7 лет следует круглогодично организовывать занятия по физическому развитию детей на открытом воздухе.
При организации плавания детей используются бассейны, отвечающие санитарно-эпидемиологическим требованиям к плавательным бассейнам.
Продолжительность нахождения в бассейне в зависимости от возраста детей должна составлять: в младшей группе – 15-20 мин., в средней группе – 20-25 мин., в старшей группе – 25-30 мин., в подготовительной группе – 25-30 мин. Для профилактики переохлаждения детей плавание в бассейне не следует заканчивать холодовой нагрузкой.
Прогулку детей после плавания в бассейне организуют не менее чем через 50 минут, в целях предупреждения переохлаждения детей.
Более подробно информация изложена в СанПиН 2.4.1.3049-13 «Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы дошкольных образовательных организаций»
Новые СанПиН: все будет хорошо?
На днях вышли новые санитарно-эпидемиологические правила работы образовательных организаций.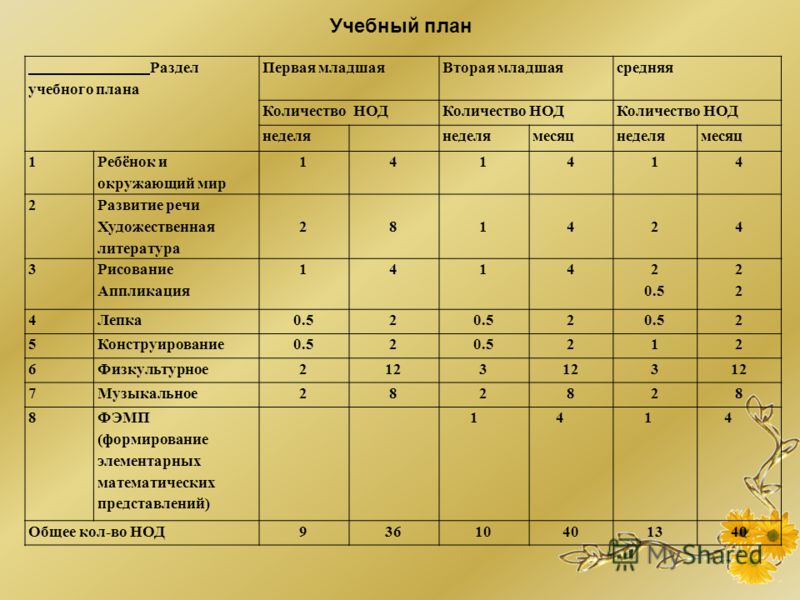 Опубликованы они были довольно неожиданно – 18 декабря, а действовать начнут уже с первого января 2021 года. Правила вызвали волнение на рынке — в первую очередь, благодаря своему внезапному появлению. Обычно об их изменении известно заранее, а вступают в силу они не раньше, чем через три-шесть месяцев после публикации. Главный архитектор Martela Анна Шапиро знает о СанПиН все – она разобралась, есть ли повод для волнения у проектировщиков школ и детских садов, и рассказала об этом нам. Мы публикуем видео-версию разбора, а также его текстовую запись.
Опубликованы они были довольно неожиданно – 18 декабря, а действовать начнут уже с первого января 2021 года. Правила вызвали волнение на рынке — в первую очередь, благодаря своему внезапному появлению. Обычно об их изменении известно заранее, а вступают в силу они не раньше, чем через три-шесть месяцев после публикации. Главный архитектор Martela Анна Шапиро знает о СанПиН все – она разобралась, есть ли повод для волнения у проектировщиков школ и детских садов, и рассказала об этом нам. Мы публикуем видео-версию разбора, а также его текстовую запись.
Новые СанПиН: есть ли повод для волнения?
Большого повода для волнения нет. Конечно, эффект внезапности заставляет всех переживать. Регламент предусматривает, что нормы вступают в силу через три или шесть месяцев после опубликования. Формально постановление санитарного врача подписано 28 сентября 2020 года.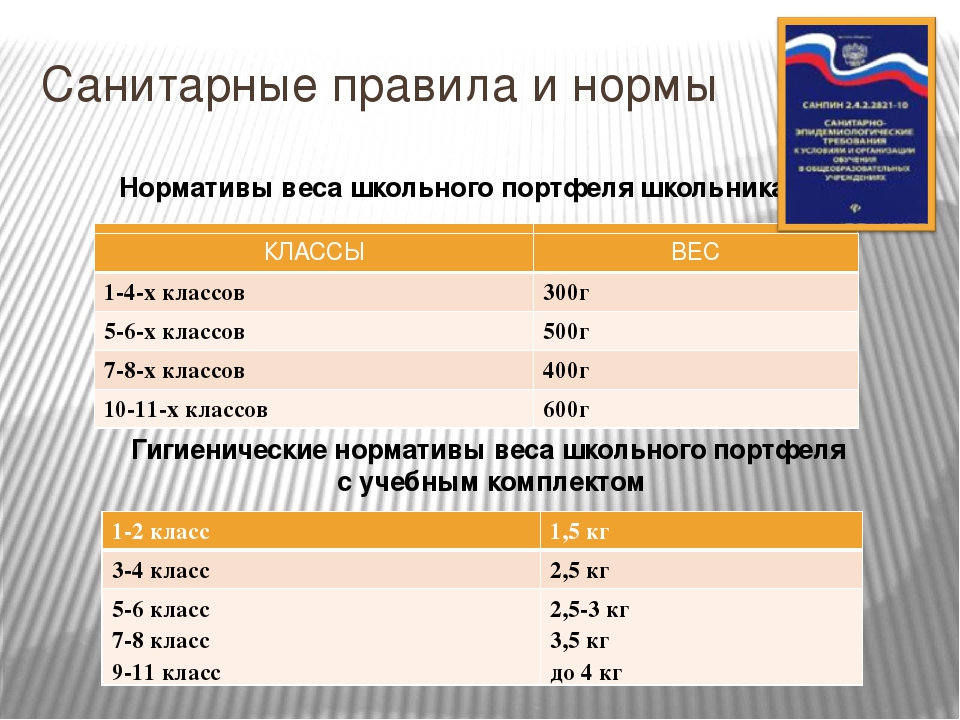
Какие правила отменили и почему?
Было 36 документов, описывающих санитарные нормы и правила. Отдельный СанПиН, регулировавший деятельность детских садов. Отдельная норма, регулирующая как деятельность, так и правила проектирования общеобразовательных школ. Норма для санаториев, для школ-интернатов для сирот, для дополнительного, профессионального, высшего образования и так далее. Все эти документы потеряли свою актуальность, вместо них вступил в силу один, новый СП, регламентирующий работу любых организаций, которые взаимодействую с детьми.
Ну, на мой взгляд, это может иметь как хорошие, так и плохие последствия. С одной стороны, теперь это всего один весьма компактный документ, в котором описано все и сразу. Мы избавлены от норм из разных документов, противоречащие друг другу. С другой стороны, документ упускает ряд решений, регламентированных ранее, что, возможно, дает некоторую неясность или даже разнообразие интерпретаций.
Новый документ принят в рамках проекта, который называется «регуляторная гильотина». Это инициатива правительства по масштабному пересмотру и отмене нормативных правовых актов, негативно влияющих на общий бизнес-климат и регуляторную среду.
Есть ли в новых нормах необязательные к исполнению пункты?
При разработке проектной документации теперь нужно руководствоваться этими правилами. Часть пунктов там обязательные, а некоторые действительно можно принять к общему сведению. И последние скорее немного конкретизируют то, что можно было недопонять в обязательных нормах.
Что
стало проще с введением новых СанПиН?Спасибо регуляторной гильотине — без задвоенных требований стало легче. Например, было нормируемое расстояние от здания до площадки для сбора мусора. Для детских садов одно, для школ другое. Для СанПиНа, который регулировал организацию общественного питания в школе, то есть школьную столовую, это расстояние было третьим. А еще есть норма градостроительная, и там четвертое число. Осталась только градостроительная норма. Точка. Нам хотя бы не нужно выбирать из восьми значений.
Или, например, есть общие санитарные нормы, которые регулируют правила инсоляции — естественной освещенности всех зданий, жилых и общественных. А также были отдельные нормы по школе, где было прописано, какие помещения должны инсолироваться , какие могут не инсолироваться. И то, что было написано в СанПиНе по школам противоречило общему СанПиНу инсоляции. Сейчас есть один СанПиН про детские учреждения, и он больше не требует смотреть в разные места и выбирать значение, которое удобно нам или которое обезопасит эксперта, проверяющего наш проект. Есть одна норма, только СанПиН по инсоляции. И это хорошо. Однозначное требование всегда лучше, чем неопределенность.
Есть ли сенсационные изменения?
Шокирующим стало, казалось бы, невинное замечание, что «некоторые помещения могут быть трансформируемыми». Мы уже несколько лет делаем трансформируемые классы, это не новость. Но в новых санитарных правилах написано, что трансформируемым может быть и обеденный зал.
Поскольку обеденный зал был непреложным, обязательным помещением, в котором мы должны показать такую рассадку детей, что позволит накормить их в две перемены, то это помещение всегда оказывалось огромным. И… неиспользуемым. Потому что, по санитарному регламенту, его можно использовать только для приема пищи и, возможно, проведения дискотеки. И получалось такое ужасное расточительство с точки зрения как строительных затрат, так и эксплуатации. Если мы теперь можем проектировать его трансформируемым, то я в ближайшем проекте сделаю обеденный зал небольшим и перетекающим, например, в какую-нибудь примыкающую рекреацию или вестибюль.
Еще мне кажется сенсационным то, что из обязательного набора помещений пропал перечень помещений для медицинского блока. Я проектирую достаточно давно, и помню, как список этих помещений для медблока расширялся. В какой-то момент там обязательно должен был появиться прививочный кабинет, потом стоматологический кабинет. А сейчас написано, что нужно просто соответствовать федеральному закону об образовании. А федеральный закон об образовании говорит нам, что при оказании первичной помощи образовательная организация обязана предоставить безвозмездно медицинской организации помещение. Одно, соответствующее условиям и требованиям для оказания помощи. Либо оказать эту помощь в специализированной медицинской организации. Больше нет необходимости раздувать площадь медицинского блока.
Есть ли неоднозначные нормы?
Что плохого в том, что нормы стали короче? У нас, казалось бы, появилась свобода маневра. Плохо это тем, что обнаружили и лакуны. Для инвестора, который желает сократить затраты, стало больше возможностей для маневра. А для специалиста государственной или частной экспертизы, который делит с нами ответственность за проект, для него новый закон принес больше рисков.
Собственно, что будет? Конфликты интерпретаций проектировщиков и экспертов. Когда нет четкого руководства, то эксперт может начать опираться на норму, которая действовала до того или оценивать ее по своему субъективному мнению.
Появились или сохранились в СанПиН какие-то особо ужасные требования?
Из ужасного — требование накормить всех детей в две перемены (при этом время на еду сократилось). Мы сейчас проектируем обеденные залы, позволяющие накормить школьников в том числе в три перемены.
Еще из неприятного — изменившаяся норма площади для мастерских: швейных, дерево- и металлообработки, учебных мастерских. Раньше было задвоение, был СанПиН по школам, который говорил: «6 кв. метров на ребенка», и действующие СП (строительные правила), в которых написано «7,5 кв. метров на ребенка». Школьную норму упразднили — осталась большая норма площади по СП «Общественные здания». И сейчас в проектах, которые мы готовили, нам надо будет где-то искать резерв для тех мастерских, которые мы предусмотрели без запаса.
Что мне, например, очень не понравилось в новой норме — правила озеленения территории. Когда-то давно, в норме было написано, что территория школы или детского сада, или интерната должна быть озеленена не менее чем на 50%. Потом этот пункт норм гласил, что территория должна быть озеленена из расчета не менее 50%, не считая площади застройки. Что уже легче, и выглядело довольно резонно. В новой же норме написано, что территория должна быть озеленена из расчета не менее 50% площади, свободной от застройки и спортивных площадок. И на мой взгляд это грустно. Вообще-то территории школ, детских садов и интернатов, поскольку они расположены в жилой застройке, были еще и рекреационными зонами. Зелеными буферными зонами, зелеными массивами этих жилых районов. Соответственно, сейчас зелень все сокращается и сокращается. И это, мне кажется, весьма тревожным.
Инклюзия: новые нормы
Новый СанПиН регламентирует еще одну новую и неисследованную ранее зону — инклюзию. Раньше школьные регламенты по ней были совершенно невнятными. Есть действующая норма, которая говорит, что людям с ограниченными возможностями здоровья должны быть оказаны все услуги, и они должны иметь доступ везде и всюду, куда есть доступ у остальных людей.
Это справедливое требование. Однако оно приводило к странным вещам. Например, мы проектируем детский сад в три этажа и получаем задание, что инвалид-колясочник должен иметь возможность находиться в групповой на третьем этаже. Это тянуло за собой существенные и не всегда обоснованные затраты ресурсов на инженерию и дополнительные помещения, которые обеспечивали бы безопасность этого человека при пожаре. Теперь новый СанПиН описывает эти решения очень внятно.
Теперь есть нормы и для дистанта?
Появился новый раздел, которого раньше не было вообще. Это раздел, который касается дистанционного обучения. Он регламентирует, на каких устройствах дети должны дистанционно учиться, сколько времени должен проходить урок — не больше сорока минут. Может быть, это ограничение связано с ограничением бесплатной версии Zoom?
Из норм пропало требование, которое раньше не исполнялось никем, кроме, может быть, некоторых московских и питерских крупных школ. Предыдущая школьная норма требовала всех детей учить в одну смену. Сейчас это требование отсутствует. Фигурирует только, что не больше, чем в две смены, начальная и старшая школы в одну смену.
В итоге новые СанПиНы — это хорошо или плохо?
Новые нормы — это очень хорошо, на мой взгляд. Потому что исключены задвоение и дублирование противоречащих друг другу правил. Пока новые СанПиН мне скорее нравятся, чем не нравятся.
Когда и какие справки нужны в школу и детский сад – Инструкции и советы – Москва и Подмосковье
10 февраля министр образования Московской области Ирина Каклюгина в своем Instagram-аккаунте сообщила, что с 2021 года изменился порядок предоставления справок в учебные заведения.
Ранее правила приема детей в детский сад и в школу были установлены разными СанПиН, говорит ведущий юрист «Европейской юридической службы» Оксана Красовская.
По дошкольным учреждениям вопрос справок регламентировался Постановлением Главного государственного санитарного врача РФ от 15.05.2013 N26 (ред. от 27.08.2015) об утверждении СанПиН 2.4.1.3049-13 «Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы дошкольных образовательных организаций». Согласно документу, «после перенесенного заболевания, а также отсутствия более 5 дней (за исключением выходных и праздничных дней) детей принимают в дошкольные образовательные организации только при наличии справки с указанием диагноза, длительности заболевания, сведений об отсутствии контакта с инфекционными больными».
Что касается школ, то тут порядок был регламентирован Постановлением Главного государственного санитарного врача РФ от 29.12.2010 N189 (ред. от 24.11.2015) об утверждении СанПиН 2.4.2.2821-10 «Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях». В нем говорилось, что школьники могли быть допущены к занятиям после перенесенного заболевания только при наличии справки от врача-педиатра. А за сколько дней отсутствия нужна была справка, документ не устанавливал.
Сравнивая два акта, Красовская отмечает, что для дошкольных учреждений четко говорилось, через сколько дней нужно было получать документ из поликлиники. Школьникам же справка нужна была только после перенесенного заболевания. А вот ситуации, когда ребенок не ходил в школу по семейным обстоятельствам или по каким-то другим причинам, на уровне федерального законодательства не регламентировались.
Что делать, если на работе заставляют прививаться от коронавируса>>
Мы выяснили сколько дней можно пропустить в школе и саду без справки
Вопросы возникли в связи с отменой санитарных правил, регулирующих правило пяти дней, и принятием новых – СанПиН СП 2.4.3648-20 «Санитарно-эпидемиологические требования к организациям воспитания и обучения, отдыха и оздоровления детей и молодежи».
Положениями новых СанПиН СП 2.4.3648-20 «Санитарно-эпидемиологические требования к организациям воспитания и обучения, отдыха и оздоровления детей и молодежи» не установлен допустимый срок отсутствия детей в образовательных организациях, если попуск не связан с заболеванием.
Единственное четко сформулированное правило – если пропуск связан именно с болезнью, то справка от педиатра нужна в любом случае, независимо от количества дней пропуска (пункт 2.9.4 СанПиН СП 2.4.3648-20):
«после перенесенного заболевания вне зависимости от продолжительности болезни дети допускаются к посещению занятий в школе при наличии медицинского заключения».
В Федеральном законе «Об образовании в РФ» от 29.12.2012 № 273-ФЗ регулирование вопроса о допустимом количестве дней пропуска школы без предоставления справки от педиатра, пока по-прежнему отсутствует.
Таким образом, исходя из указанного положения, справку от педиатра Вы обязаны предоставлять только, если ребенок отсутствовал по болезни.
От имени ОУЗС мы сделали запрос в Роспотребнадзор об уточнении этих положений и во избежание самодурства некоторых образовательных организаций.
Содержание официального ответа Управления Роспотребнадзора по Санкт-Петербургу подтверждает этот вывод о том, что справка нужна только, если пропуск вызван болезнью, а допустимое количество дней пропуска каждая образовательная организация устанавливает самостоятельно.
Поэтому если в образовательной организации Вам заявили о недопустимости пропуска более 1 дня – потребуйте ознакомить Вас с локальным документов, где это требование зафиксировано.
Если не зафиксировано нигде – значит, этого правила не существует, в связи с чем Ваш ребенок может отсутствовать в образовательной организации в течение разумного срока.
Понятие «разумный срок» применяется везде, где законом не установлен срок конкретный, и представляет собой срок, который необходим для осуществления чего-либо (ст.314 Гражданского кодекса РФ определяет это понятие применительно к обязательствам).
Например, для участия в шахматном турнире необходимо три свободных дня; для отсутствия по семейным обстоятельствам – согласовать тот самый разумный срок, когда 1 день – это мало, а месяц – много.
Адекватные, здравомыслящие педагоги и руководители образовательных организаций вряд ли будут выдвигать неразумные требования и не желать «войти в положение».
Если в Вашей образовательной организации педагогический и руководящий состав не обладает перечисленными ценными качествами, то следует напомнить им, что право каждого на образование гарантировано ч.1 ст. 43 Конституции РФ, а ч. 2 ст. 3 Федерального закона от 29.12.2012 N 273-ФЗ (ред. от 31.07.2020) “Об образовании в Российской Федерации” также предусматривает недопустимость дискриминации в сфере образования.
Поэтому если Вы столкнулись с абсурдными и самоуправными требованиями руководства образовательных организаций о недопустимости отсутствия ребенка в образовательной организации без справки вообще, или допустимости отсутствия, но в неразумный срок, например – не более 1 дня, либо предъявлены иные незаконные дополнительные требования, например, обязательно пройти тестирование на коронавирусную инфекцию и пр., то рекомендуем воспользоваться нашим бланком жалобы.
СКАЧАТЬ => Бланк жалобы
Ответ РПН
ВНИМАНИЕ! ЕСТЬ ДОПОЛНЕНИЕ!
Благодаря стараниям одной из наших активных и неравнодушных соратниц, мамы из Санкт-Петербурга, дополняем наш материал важным аргументом.
Согласно разъяснениям, содержащимся в Письме Министерства здравоохранения РФ от 19 августа 2020 г. N 15-2/И/2-11861 «О мерах по обеспечению безопасных условий деятельности образовательных организаций в условиях сохраняющихся рисков распространения новой коронавирусной инфекции COVID-19» допускается отсутствие ребенка в образовательной организации без справки от педиатра, если оно продлилось не более 5 дней.
Наличие справки с указанием диагноза, длительности заболевания, сведений об отсутствии контакта с инфекционными больными, требуется только в случае отсутствия более 5 дней (за исключением выходных и праздничных дней).
Таким образом, «правило 5 дней» до сих пор действует в форме официальной рекомендации, которую соблюдать должны все образовательные организации.
Письмо прокуратуры, содержащее этот подробный и мотивированный ответ, прикрепляем для ознакомления и использования для защиты прав детей. Можете использовать.
В СанПиН 2.4.1.3049–13 внесены изменения — Блог инспектора народного образования
Постановлением Главного государственного санитарного врача РФ от 27 августа 2015 года N 41 в СанПиН 2.4.1.3049–13 ( для дошкольных образовательных организаций) внесены изменения, которые вступили в силу 20 сентября 2015 года. Согласно внесенным изменениям:
1.Действие СанПиН 2.4.1.3049–13 распространяется на деятельность по уходу и присмотру за детьми в дошкольных группах, размещенных во встроенных, встроенно-пристроенных к жилым домам зданиях (помещениях) и зданиях административного общественного назначения (кроме административных зданий промышленных предприятий). При этом к дошкольным группам, размещенным в жилых помещениях жилищного фонда, санитарные правила не применяются.
2.Исключено предельное возрастное ограничение по приему детей в детские сады. Теперь дети будут приниматься в дошкольную образовательную организацию в возрасте от двух месяцев до прекращения образовательных отношений (сейчас — до 7 лет).
3.Для дошкольных образовательных организаций, оказывающих услуги по присмотру и уходу за детьми допускается использование оборудованных мест для прогулок детей и занятий физкультурой, расположенных на территории скверов, парков и других территориях, которые приспособлены для прогулок детей и занятий физкультурой. 4. Уточнено, что количество кроватей в детских садах должно соответствовать количеству детей, находящихся в группе. При этом исключена норма об обеспечении детей индивидуальными постельными принадлежностями, полотенцами, предметами личной гигиены. Однако сохранена норма, согласно которой на каждого ребенка необходимо иметь три комплекта белья, включая полотенца для лица и ног, и две смены наматрасников.
4.Запрещено проведение сквозного проветривания помещений детского сада в присутствии детей и через туалетные комнаты. Проветривание проводится не менее 10 минут через каждые 1,5 часа.
5.Уточнена кратность приема пищи и режим питания детей. Так при 8-10-часовом пребывании детей должно быть организовано 3-4-разовое питание, при 10,5-12-часовом – 4-5-разовое питание, при 13-24-часовом – 5-6-разовое питание. Между завтраком и обедом возможна организация второго завтрака. Подчеркивается, что для детей, начиная с 9-месячного возраста, оптимальным является прием пищи с интервалом не более 4 часов.
6.Внесены поправки в температурный режим. Например, в спальнях, туалетных комнатах температура воздуха должна быть не ниже 19 градусов (ранее – 19-20), в игровых – 22 (ранее – 21-23).
7.Изменена примерная схема питания детей первого года жизни. В частности, расширен перечень продуктов и блюд, а также уточнены объемы их употребления по месяцам жизни ребенка.
Источник: ГАРАНТ.РУ: http://www.garant.ru/news/651621/
«Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы дошкольных образовательных организаций»
постановление Главного государственного санитарного врача РФ от 27 августа 2015 г. № 41
Пропустил день, неси справку. Законны ли новые требования омских школ и детских садов? – Новости Омска
Во время учебного года родители часто сталкиваются с ситуацией, когда ребёнка нужно «немного подлечить». Как правило, в таких случаях посещать образовательное учреждение не рекомендуется, иначе можно попасть в неловкую ситуацию и заразить других детей. Если ребёнок всё же разболелся и без помощи врача не обошлось, то возвращаться в школу или детский сад необходимо только со справкой.
В детском саду можно пропустить 5 дней без предъявления справки. При этом выходные и праздничные дни не учитываются. Значит, по факту, можно пропустить целую неделю.
Постановление Главного санитарного врача РФ «Об утверждении СанПин 2.4.1.3049–13 Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы дошкольных образовательных организаций» пункт 11.3 гласит, что ребёнок должен предоставить справку при отсутствии более 5 дней, за исключением праздничных и выходных дней.
Важно заметить, что если ребёнок заболел и понадобилась помощь врача, то в таком случае справку необходимо будет предоставить, даже если удалось вылечиться за 5 дней.
| При первичном посещении детского сада необходимо предоставить справку с пометкой об отсутствии контакта с коронавирусными больными. |
Пропустили один день? Будьте добры предоставить справку
Со школами дела обстоят иначе. В разных школах предоставляют разную информацию по вопросам пропуска учащихся без справки. Родители одной омской школы рассказали, какие правила установлены у них:
«У ребёнка немного приболело горло, я решила за выходные его немного подлечить и захватить понедельник. Спросила у классного руководителя: можно в понедельник один день не выйти? Она ответила, что в связи с ковидом правила ужесточились. Теперь даже если пропускаешь один день, необходимо основание, почему ребёнок отсутствовал. Раньше можно было пропустить не более 4-х дней».
Похожая ситуация обнаружилась ещё в одном образовательном учреждении. Омичка поделилась, что без справки нельзя пропускать ни одного дня, однако если пропуск по семейным обстоятельствам, то можно написать заявление.
Возвращаемся к постановлению Главного санитарного врача РФ:
«Санитарно-эпидемиологические требования к условиям и организации обучения, содержания в общеобразовательных учреждениях» гласят, что обучающиеся допускаются к занятиям в общеобразовательной организации после перенесённого заболевания только при наличии справки врача-педиатра.
Никакой речи о количестве дней, которые можно пропустить нет. Школы вправе сами определять допустимое количество дней, которые можно не посещать без предъявления справки. Ознакомиться с этими распоряжениями можно на официальном сайте нужной школы, в правилах внутреннего распорядка обучающихся.
«При неявке обучающегося на занятия по болезни или другим уважительным причинам, обучающийся обязан в течение первого дня болезни поставить об этом в известность классного руководителя; в случае болезни обучающийся предоставляет справку амбулаторного врача или лечебного заведения по установленной форме», — написано на сайте одной из школ города.
В другой школе можно воспользоваться запиской от родителей за пропуск занятий: «Нельзя без разрешения педагогов уходить из школы и с ее территории в урочное время. В случае пропуска занятий обучающийся должен предъявить классному руководителю справку от врача или записку от родителей (законных представителей) о причине отсутствия на занятиях. Пропускать занятия без уважительных причин не разрешается».
В пресс-службе департамента образования рассказали, какие правила действуют в регионе:
Закон «Об образовании в РФ» ничего не говорит о том, сколько дней позволено пропускать школу. В школах самостоятельно определяют допустимые сроки отсутствия на занятиях. Уважительная причина должна быть указана в заявлении, которое нужно написать на имя директора. В нем также нужно прописать просьбу освободить ребенка от уроков на необходимое время. Справка от врача после этого в школе не нужна. Если же ребенок пропустил занятия по причине болезни, справка о состоянии здоровья обязательна. Ребенок может пропустить школу в срок менее 3-х дней до открытия больничного. Регулировку правил предусматривают внутренние акты, установленные школой.
Исходя из вышесказанного можно предположить, что при отсутствии 1-2 дней можно не обращаться за справкой к педиатру. Но каждая школа имеет полное право диктовать свои условия на этот счёт. В случае длительного отсутствия можно написать заявление с указанием интервала времени, в который будете отсутствовать и причину.
Возможно, из-за напряжённой эпидемиологической ситуации школы хотят себя обезопасить и требуют справки даже за один день пропуска. Во всех учреждениях проводятся утренние фильтры, которые помогают выявить температуру у ребёнка или первые признаки ОРВИ.
На пресс-конференции, посвященной соблюдению масочного режима в Омской области первый заместитель директора департамента образования Наталья Васильева подчеркнула, что прежние правила сейчас не действуют. В школе действительно имеют право потребовать справку за пропуск даже одного дня учёбы, чтобы удостовериться, что ребёнок не болеет. По словам спикера, до пандемии школьнику позволялось «пересидеть один день дома» и не предъявлять документов о состоянии здоровья, однако сейчас сложилась иная ситуация.
«В сложившихся обстоятельствах каждый родитель и руководитель должны обеспечить сохранение здоровья», – цитирует Наталью Васильеву Город55.
Вопрос
При пропуске скольких дней в вашей школе начинают требовать справки?
- 1 день
- 3 дня
- 4 дня
Уже почти 80. Омские школы продолжают закрывать на карантин из-за коронавируса и ОРВИ
Модуляция клеточного распределения геликазы цитомегаловируса человека с помощью Snapin клеточного фактора
РЕЗЮМЕ
Контролируемая регуляция синтеза геномной ДНК – это универсально консервативный процесс для всех герпесвирусов, включая цитомегаловирус человека (HCMV), и играет ключевую роль в вирусном патогенезе. такие как стойкие инфекции. Считается, что HCMV UL105 кодирует геликазу механизма репликации ДНК, который должен локализоваться в ядрах, месте синтеза вирусной ДНК.Факторы хозяина, которые взаимодействуют с UL105, не идентифицированы. В этом исследовании мы показываем, что UL105 специфически взаимодействует с Snapin, человеческим белком, который преимущественно локализован в цитоплазме и связан с клеточными везикулами. Было обнаружено, что UL105 взаимодействует со Snapin как в дрожжевом двугибридном скрининге, так и в экспериментах по коиммунопреципитации в клетках, инфицированных HCMV. Ядерный и цитоплазматический уровни UL105 были снижены и увеличены в клетках, сверхэкспрессирующих Snapin, соответственно, в то время как уровни UL105 в ядрах и цитоплазме увеличивались и уменьшались в клетках, в которых экспрессия Snapin подавлялась малой интерферирующей РНК анти-Snapin ( миРНК) соответственно.Кроме того, синтез вирусной ДНК и продукция потомства снижались в клетках, сверхэкспрессирующих Snapin, и увеличивались в клетках, обработанных анти-Snapin siRNA, соответственно. Наши результаты являются первым прямым доказательством того, что Snapin взаимодействует с UL105 и изменяет его клеточное распределение, что приводит к модуляции синтеза вирусной ДНК и продукции потомства. Наше исследование также предполагает, что модуляция клеточного распределения вирусной геликазы с помощью Snapin может представлять собой возможный механизм регулирования синтеза геномной ДНК HCMV, ключевой этап во время литических и персистирующих инфекций герпесвируса.
ВВЕДЕНИЕ
Цитомегаловирус человека (HCMV) является членом семейства герпесвирусов, которое включает вирус простого герпеса 1 (HSV-1), вирус Эпштейна-Барра (EBV) и вирус герпеса, связанный с саркомой Капоши (KSHV) (1) . Этот вирус вызывает легкие или субклинические заболевания у иммунокомпетентных взрослых, но может привести к тяжелой заболеваемости или смертности у новорожденных и лиц с ослабленным иммунитетом (1, 2). HCMV может инфицировать широкий спектр тканей и клеток, таких как нейрональные клетки, и, как и все другие герпесвирусы, он может вызывать литические, стойкие и латентные инфекции во многих из этих тканей (3, 4).Во время литической продуктивной инфекции продукты гена HCMV экспрессируются во времени, и их экспрессия состоит из трех последовательных фаз, описываемых как немедленная ранняя (IE), ранняя (E) и поздняя (L) фазы (1). Процесс синтеза вирусной ДНК, который происходит в ядре инфицированных клеток (5), является высококонсервативным среди всех герпесвирусов и является мишенью для большинства современных антигерпесвирусных терапевтических агентов, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (6).
Литическая репликация ДНК герпесвирусов считается сложным и строго регулируемым событием.Комплекс репликации вирусной ДНК содержит не менее шести основных белков, консервативных у всех герпесвирусов (1, 7). Факторы репликации HCMV состоят из двухсубъединичной ДНК-полимеразы, кодируемой UL54 и UL44, одноцепочечного ДНК-связывающего белка, кодируемого UL57, примазы, кодируемой UL70, геликазы, кодируемой UL105, и фактора, связанного с примазой-геликазой. кодируется UL102. Репликация ДНК в HCMV считается аналогичной репликации в HSV и других герпесвирусах с функцией нескольких белков HCMV (например,g., UL70 и UL105), прогнозируемые на основе последовательности и функциональной гомологии с их аналогами в HSV (1, 5).
HCMV UL105, как полагают, кодирует вирусную геликазу, потому что этот белок содержит шесть мотивов (от I до VI), типичных для суперсемейства 1 класса белков геликазы, которые являются высококонсервативными не только среди всех секвенированных изолятов HCMV, но и среди 32 гомологов геликазы хозяина ( 7). Хеликаза HCMV и ее герпесвирусные гомологи образуют плотный комплекс геликаза-примаза, который состоит из UL105, UL70 и UL102 в HCMV (7-10).Считается, что геликаза UL105 отслеживает отстающую цепь и раскручивает ДНК перед репликационной вилкой, в то время как примаза, кодируемая UL70, синтезирует короткие праймеры РНК для одноцепочечной ДНК, которую ДНК-полимераза удлиняет посредством полимеризации дезоксинуклеозидтрифосфата (1, 5). Хотя точная роль каждой субъединицы требует дальнейшего изучения, можно ожидать, по аналогии с наблюдениями на других герпесвирусах (например, HSV-1), что собранный субкомплекс, содержащий субъединицы UL105 и UL70, сохраняет ферментативную активность, в то время как субъединица UL102 модулирует эти виды деятельности (8, 11–13).
Поскольку репликация геномной ДНК герпесвирусов происходит в ядрах, все белки репликации HCMV, такие как UL105, необходимо импортировать в ядра (14). Были проведены исследования для идентификации белков человека, которые потенциально взаимодействуют с белками HCMV и модулируют их транспорт к ядрам (1). Например, было обнаружено, что многие белки HCMV, в том числе коровые белки репликации ДНК UL44, UL54 и UL57, которые обладают сигнальными последовательностями ядерной локализации (NLS), взаимодействуют с клеточным импортином человека для облегчения их импорта в ядро через комплекс ядерных пор. (15–20).Совсем недавно наша лаборатория (21) показала, что UL70 взаимодействует с клеточным Snapin, белком, ассоциированным с клеточными пузырьками, который преимущественно локализован в цитоплазме (22-24). Модуляция экспрессии Snapin влияет на ядерное и цитоплазматическое распределение UL70, а также на уровни геномной репликации ДНК HCMV и продукцию потомства в культивируемых клетках (21). Эти результаты предполагают, что контроль ядерного импорта и доступность белков репликации HCMV может представлять собой ключевой шаг в регулировании репликации вирусной ДНК.Однако не сообщалось, как кодируемая UL105 эссенциальная геликаза импортируется в ядерный компартмент, где происходит репликация вирусной ДНК (25). Столь же неуловимо то, как модулируется сотовое распространение UL105. В настоящее время нет сообщений о взаимодействии UL105 с какими-либо белками человека.
В этом исследовании мы провели двухгибридный дрожжевой скрининг для выявления белков человека, которые потенциально взаимодействуют с UL105. Наши результаты являются первым прямым доказательством того, что UL105 взаимодействует со Snapin в домене, отличном от домена, связанного с UL70.Кроме того, наши результаты предполагают, что, изменяя клеточную локализацию UL105, Snapin может играть роль в модулировании синтеза вирусной ДНК и литической продуктивной инфекции и может представлять собой возможное средство регулирования персистирующей вирусной инфекции во время патогенеза HCMV.
МАТЕРИАЛЫ И МЕТОДЫ
Антитела, вирусы и клетки. Клетки астроцитомы человека U373MG и глиобластомы U251 были получены от Sigma, Inc. (Сент-Луис, Миссури) и Американской коллекции типовых культур (ATCC; Manassas, VA), соответственно.Фибробласты крайней плоти человека (HFF) и клетки U251, HeLa, U373MG и 293T поддерживали в среде Игла, модифицированной Дульбекко (DMEM) с добавлением 10% фетальной бычьей сыворотки (26, 27) и HCMV (штаммы Towne и Towne BAC ). был размножен в этих клетках, как описано ранее (28). Антитела против человеческого актина и Snapin были приобретены у Sigma, Inc. (Сент-Луис, Миссури) и Santa Cruz Biotech, Inc. (Санта-Крус, Калифорния), соответственно. Моноклональные антитела, которые реагируют с белками HCMV UL44, IE1 и gH, были описаны ранее (29, 30).
Для экспрессии антигенов для генерации моноклональных антител против UL70 и против UL105, последовательности, кодирующие UL70 и UL105, клонировали в вектор экспрессии pET-28a (+) (Novagen, Madison, WI). His-меченный UL105 экспрессировали в штамме Escherichia coli BL21 (DE3), очищали гель-электрофорезом и затем использовали для иммунизации мышей BALB / c. Клетки селезенки выделяли от иммунизированных мышей и сливали с клетками миеломы. Положительные слитые клетки отбирали с использованием культуральной среды гипоксантин-аминоптерин-тимидин и иммуноферментного скрининга.Полученные моноклональные антитела собирали из супернатантов культуральной среды положительных культур гибридомных клеток и хранили при -20 ° C. Далее мы охарактеризовали реактивность антител с помощью вестерн-блоттинга, коиммунопреципитации (co-IP) и непрямых иммунофлуоресцентных анализов.
Для создания клеточных линий U251-S, U251-SΔh2, U251-SΔh3 и U251-C использовали ДНК конструкций pCMV-Snapin / UL105, pCMV-SΔh2, pCMV-SΔh3 и пустой вектор [pCDNA3.1 ( +)] соответственно котрансфицировали в клетки U251 с ДНК вектора LXSN (26, 29).Через 48-72 ч после заражения в культуральную среду добавляли неомицин до конечной концентрации 600 мкг / мл. Затем клетки отбирали в присутствии неомицина в течение 2 недель и клонировали устойчивые к неомицину клетки (31, 32). Уровни Snapin и его мутантов в индивидуальных клонах клеток определяли Вестерн-анализом.
Конструкция плазмиды. Конструкции плазмиды, полученные в этом исследовании, перечислены в таблице 1. Конструкция pUL105 была получена из ДНК Towne BAC (28), а конструкция pCMV-XLS-Snapin, содержащая кодирующую последовательность Snapin, была получена из ДНК. приобретено у Origene, Inc.(Роквилл, Мэриленд). Конструкция pGBKT7-UL105, которую использовали для двугибридного скрининга дрожжей, была создана путем клонирования последовательности, кодирующей UL105 HCMV, в pGBKT7, расщепленную NdeI / BamHI (Clontech, Mountain View, CA). Конструкция pCMV-Myc-UL105, которую использовали для экспрессии в клетках человека, была создана путем клонирования последовательности, кодирующей UL105, в расщепленную SalI / KpnI pCMV-Myc (Clontech).
Таблица 1Плазмидные конструкции, использованные в исследовании
Для создания конструкций pGADT7-Snapin / UL105 и pRK11-FLAG-Snapin, используемых для экспрессии в штамме Saccharomyces cerevisiae Ah209 и в клетках человека, кодирующая последовательность Snapin была амплифицирована с помощью ПЦР с использованием праймеры SNAPIN-F (5′-ATGGATCCTAATGGCGGGGGCTGGTT-3 ′) и SNAPIN-R (5′-ATACTCGAGAATTCTTATTTGCCTGGGGAGCCA-3 ′), а затем вставлены в расщепленные BamHI / XhoI pGADI / FLAGI / расщепленные с помощью EcoR11 pGADT7 и BamR11 соответственно.Конструкции, содержащие последовательности, кодирующие различные мутанты с делецией Snapin, были созданы с помощью ПЦР с использованием pGBKT7-Snapin в качестве матрицы с последующей вставкой амплифицированных продуктов ПЦР в pGBKT7, расщепленный NdeI / BamHI, для двухгибридного анализа дрожжей и расщепленный SalI / KpnI pCMV-Myc и pCDNA3.1 (+) для экспрессии в клетках человека. Полученные конструкции подтверждали профилем рестрикционного переваривания и секвенированием. Конструкция, содержащая последовательность UL83 HCMV, была создана в соответствии с процедурами, описанными ранее (27).
Двухгибридный анализ дрожжей. Мы получили библиотеку кДНК головного мозга плода человека и соответствующие двухгибридные реагенты для скрининга дрожжей (например, штамм Saccharomyces cerevisiae Ah209 и контрольный вектор pGADT7) от Clontech (Mountain View, CA). Мы трансформировали дрожжевой штамм, содержащий pGBKT7-UL105, библиотекой, отобрали положительные клоны на синтетической среде исключения (SD), не содержащей четырех питательных веществ, триптофана, лейцина, аденина и гистидина (SD-минус Trp / Leu / Ade / His; четырехкратное выпадение [ QDO]) и протестировали положительные клоны на активность β-галактозидазы с помощью анализа с фильтром подъема колоний в соответствии с процедурами, рекомендованными производителем, как описано ранее (27).Затем мы экстрагировали конструкции ДНК, содержащие последовательность, кодирующую партнеров по взаимодействию UL105 (обозначенную pACT2-кДНК) из положительных колоний, и последовательности гена человека в конструкциях pACT2-кДНК из этих положительных колоний определяли с помощью праймера для секвенирования 5 ′ -AATACCACTACAATGGAT-3 ′ (27).
Коиммунопреципитация и вестерн-блот-анализ. Мы котрансфицировали клетки плазмидной ДНК с помощью реагента Lipofectamine (Invitrogen, Carlsbad, CA). Через 48 часов после трансфекции мы собрали клеточные лизаты и провели эксперименты по коиммунопреципитации, используя наборы FLAG tag IP / co-IP для млекопитающих и c-Myc tag IP / co-IP, следуя протоколу производителя (Pierce, Rockford, IL) (27) .В экспериментах по вестерн-анализу денатурированные полипептиды из клеточных лизатов или со-IP разделяли электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и переносили электрически на нитроцеллюлозные мембраны. Мембраны блокировали в 5% сухом молоке в фосфатно-солевом буфере (PBS) плюс 0,2% Tween 20, окрашивали различными антителами и реагировали в иммуноферментном анализе с разведенными лошадьми антимышиными IgG антителами 1: 2000, конъюгированными с пероксидаза хрена (Vector Laboratories, Burlingame, CA).Затем мембраны окрашивали хемилюминесцентным субстратом с помощью наборов реагентов для обнаружения вестерн-блоттинга с усиленной хемилюминесценцией (GE Healthcare) и количественно определяли либо денситометрией пленок, подвергшихся воздействию образцов, либо с помощью фосфорного сканера STORM840 или станции документирования гелей (Bio-Rad , Hercules, CA) (26, 29). Мы проводили опыты в двух экземплярах и повторяли их трижды. Количественное определение проводили в линейном диапазоне обнаружения белка.
Трансфекция миРНК в клетки.Клетки ( n = 1 × 10 5 ) высевали в 12-луночные планшеты и трансфицировали химически синтетической анти-Snapin h3-малой интерферирующей РНК (миРНК) и контрольными молекулами C-миРНК. Молекулы h3-миРНК представляли собой пул из трех миРНК (h3-1, h3-2 и h3-3), нацеленных на различные области мРНК Snapin, кодирующие домен h3. Олигонуклеотиды были разработаны и химически синтезированы Ribobio Co. Ltd. (Гуанчжоу, Китай) и Santa Cruz Biotech, Inc. (Санта-Крус, Калифорния). В каждой лунке 3 мкл липофектамина (Invitrogen) и 3 мкл 20 мМ миРНК разводили в 12 мкл Opti-MEM и 50 мкл Opti-MEM (Invitrogen) соответственно.Затем мы объединили оба раствора при комнатной температуре через 5 мин. Через 20 мин мы добавляли 400 мкл предварительно нагретого Opti-MEM к каждой реакционной смеси для трансфекции, которую затем добавляли к клеткам. Через 10 часов после трансфекции мы удалили среду, содержащую миРНК, промыли клетки и затем инкубировали клетки с полной DMEM с добавлением 10% фетальной бычьей сыворотки. Трансфекцию повторяли один раз, и через 48 часов после второго раунда трансфекции клетки либо инфицировали, либо готовили для анализа с помощью иммуноблоттинга.
Вирусная инфекция и анализы экспрессии и роста вирусных генов. Клетки ( n = 1 × 10 6 ) были либо ложно инфицированы, либо инфицированы HCMV с множественностью инфекции (MOI) от 0,5 до 5 после экспериментальных процедур. описано ранее (26, 29). Для анализа экспрессии вирусных генов мы выделили образцы белка из инфицированных клеток через 12-72 часа после заражения, и образцы белка были проанализированы с помощью экспериментов вестерн-блоттинга, как описано ранее (29, 30).Для анализа роста вируса мы инфицировали клетки ( n = 1 × 10 5 ) HCMV с MOI 1. Мы собрали клетки и среду через 5 дней после инфицирования и приготовили исходные вирусные растворы, добавив равный объем 10%. (об. / об.) обезжиренное молоко с последующей обработкой ультразвуком. Мы определили титры исходных вирусов, инфицировав 1 × 10 5 фибробластов крайней плоти человека и подсчитав количество бляшек через 10–14 дней после инфицирования. Полученные значения были средними из трех экспериментов.
Анализ уровня внутриклеточной вирусной ДНК. Мы провели количественный ПЦР в реальном времени (кПЦР) анализ вирусной ДНК, как описано ранее (33). Вкратце, мы выделили образцы ДНК из ложно инфицированных или инфицированных HCMV клеток с использованием набора тканей DNeasy (Qiagen) в соответствии с инструкциями производителя. Уровни внутриклеточной вирусной ДНК количественно определяли с помощью праймеров P53 (5′-GTCAGCGTTCGTGTTTCCCA-3 ‘) и P33 (5′-GGGACACAACACCGTAAAGC-3′) и зонда для амплификации последовательности UL83 HCMV. Зонд TaqMan (5’-FAM-CCCGCAACCCGCAACCCTTCATG-TAMRA-3 ‘, где FAM представляет собой 6-карбоксифлуоресцеин, а TAMRA представляет собой 6-карбокситетраметилродамин) был приобретен у Applied Biosystems Inc.(Фостер-Сити, Калифорния) и был помечен на 5′-конце FAM и на 3’-конце флуоресцентным гасителем TAMRA. Мы нормализовали количество вирусных геномов к количеству клеточных копий β-актина с помощью ранее описанного набора праймеров и зонда (33). Неизвестные значения образца определяли на основе стандартной кривой известных чисел копий UL83 (Towne BAC ) и β-актина (pβ-актин). Мы провели ПЦР-амплификацию в 50-мкл реакционной смеси (которая содержала 21 мкл экстракта ДНК, 25 мкл 2-кратной мастер-смеси TaqMan Universal PCR [Applied Biosystems Inc.], 1 мкл каждого праймера при 10 мкМ, 2 мкл флуорогенного зонда при 5 мкМ) с использованием устройства ABI 7500 (Applied Biosystems Inc., Фостер-Сити, Калифорния) или системы обнаружения ПЦР в реальном времени iCycler (Bio- Рад, Геркулес, Калифорния). Условия термоциклирования были следующими: 50 ° C в течение 2 минут, 95 ° C в течение 15 минут и 45 циклов при 95 ° C в течение 30 с и 60 ° C в течение 1 минуты. Результаты ПЦР были получены в трех независимых экспериментах.
Приготовление ядерных и цитоплазматических экстрактов. Мы ресуспендировали клетки в буфере А (10 мМ HEPES [pH 7.4], 10 мМ KCl, 1 мМ дитиотреитол, 0,6% NP-40) при 4 ° C в течение 10 мин. После центрифугирования при 1000 × g в течение 5 минут супернатант собирали в виде цитоплазматической фракции, а ядерную фракцию получали путем ресуспендирования оставшегося осадка в буфере B (20 мМ HEPES [pH 7,4], 150 мМ NaCl, 1 мМ дитиотреитол. ). Мы окрашивали ядерные и цитоплазматические экстракты на наличие UL70, UL105, актина и гистона h2 с помощью иммуноблоттинга.
Иммунофлуоресцентный микроскопический анализ.Клетки (выращенные на покровных стеклах) котрансфицировали ДНК различных конструкций и через 48 часов после трансфекции либо ложно инфицировали, либо инфицировали HCMV при MOI от 1 до 5 (34). В разные моменты времени после инфицирования клетки фиксировали 4% формальдегидом, блокировали 0,1% бычьим сывороточным альбумином и 0,1% азидом натрия в PBS и окрашивали первичными антителами с последующей инкубацией со вторичными антителами Alexa Fluor 555 против IgG мыши или Alexa. Fluor 488 против кроличьих IgG (Invitrogen).DAPI (4 ‘, 6-диамидино-2-фенилиндол) использовали для окрашивания ядер (Invitrogen). Мы собрали конфокальные изображения с помощью конфокального микроскопа Olympus FV1000 по отдельным каналам и проанализировали изображения с помощью программного обеспечения Olympus Fluoview. Мы определили процент цитоплазматического и ядерного UL105 по крайней мере в трех независимых экспериментах. В некоторых экспериментах мы также получали изображения с помощью микроскопа Nikon Eclipse TE300 с использованием камеры SPOT RT Slider и программного обеспечения для обработки изображений (Diagnostic Instruments, Inc., Стерлинг-Хайтс, Мичиган) (34). Впоследствии цифровые изображения были объединены с использованием программного обеспечения SimplePCI (Compix Inc., Sewickley, PA). Для некоторых экспериментов мы также вручную подсчитали клетки, демонстрирующие различные паттерны локализации UL105, и определили процентное соотношение количества клеток по крайней мере в трех независимых экспериментах.
РЕЗУЛЬТАТЫ
Взаимодействие Snapin с UL105, выявленное с помощью двугибридного анализа дрожжей. Чтобы идентифицировать клеточные факторы, которые потенциально взаимодействуют с UL105, мы провели двухгибридный скрининг дрожжей путем трансформации S.cerevisiae Ah209, содержащий pGBKT7-UL105, который содержит полноразмерную кодирующую последовательность UL105, с библиотекой кДНК, полученной из мозга плода человека. Те дрожжевые клетки, которые росли на синтетической среде отсева (SD), лишенной четырех питательных веществ, триптофана, лейцина, аденина и гистидина (SD-минус Trp / Leu / Ade / His), и давали синие сигналы в тесте с фильтром подъема колоний для β -галактозидазной активности (27). Одна из идентифицированных конструкций, pACT2-SNAPIN / UL105, которая содержала полноразмерную кодирующую последовательность Snapin, постоянно взаимодействовала с UL105 в наших дрожжевых двухгибридных скринингах (данные не показаны).Из почти 1,5 × 10 7 протестированных независимых кДНК клонов 27 дрожжевых колоний дали положительные результаты, и 13 из них содержали плазмидные конструкции с полноразмерной кодирующей последовательностью Snapin.
Взаимодействие Snapin с UL105 в клетках человека, выявленное с помощью co-IP. В наших анализах co-IP мы сначала клонировали последовательности, кодирующие Snapin и UL105, в векторы экспрессии млекопитающих pRK11-FLAG и pCMV-Myc для создания конструкций pRK11-FLAG -Snapin и pCMV-Myc-UL105, соответственно, в которых каждая открытая рамка считывания (ORF) экспрессировалась как гибридный белок с аминоконцевой меткой FLAG и меткой эпитопа Myc, соответственно (22-24, 28).Лизаты белков из клеток глиобластомы U251 человека, трансфицированные этими конструкциями, сначала иммунопреципитировали либо анти-FLAG, либо анти-Myc, а затем иммуноблотировали с антителами против меток эпитопа FLAG и Myc. Мы наблюдали соосаждение помеченного Myc UL105 с помеченным FLAG Snapin (рис. 1, дорожки 4 и 11). Напротив, в контрольных экспериментах мы не обнаружили значительного связывания или соосаждения между UL105, меченным Myc, и UL83, меченным FLAG, HCMV, который, как известно, не взаимодействует с UL105 и служит отрицательным контролем (дорожки 1-3 и 7 для 9) (27).Мы также наблюдали аналогичные результаты в клетках HeLa, клетках 293T, клетках астроцитомы U373MG и инфицированных HCMV клетках U251, трансфицированных конструкциями, экспрессирующими меченый FLAG Snapin и меченный Myc белки UL105 (данные не показаны). Эти наблюдения подтвердили специфичность анализа co-IP и предположили, что взаимодействие UL105-Snapin может происходить в клетках человека.
Рис. 1Идентификация взаимодействия между UL105 с тегами Myc и Snapin с тегами FLAG по совместному IP. Клетки U251 человека котрансфицировали комбинацией двух плазмид, экспрессирующих белки, меченные FLAG и Myc.Клеточные лизаты получали через 48 часов после трансфекции. Образцы входящего белка (70 мкг; вход, дорожки 3, 6, 9 и 12) и образцы (10 мкг), которые были иммунопреципитированы либо анти-Myc [IP (анти-Myc), дорожки 2, 5, 8 и 11] или антитела против FLAG [IP (анти-FLAG), дорожки 1, 4, 7 и 10] разделяли на SDS-содержащих полиакриламидных гелях и анализировали с помощью анти-Myc (анти-Myc) и анти-FLAG (анти- -FLAG) антитела соответственно.
Чтобы определить, взаимодействует ли нативный (немаркированный) UL105 специфически с эндогенным Snapin в клетках человека и при наличии инфекции HCMV, мы экспрессировали UL105 в E.coli и использовали экспрессированный белок в качестве антигена для получения моноклонального антитела против UL105. Чтобы определить, может ли Snapin неспецифически взаимодействовать с другими вирусными белками в дополнение к UL105, мы также исследовали, связан ли Snapin с UL44, который кодирует фактор процессивности полимеразы HCMV, необходимый для репликации вирусной ДНК (1). Белковые лизаты из инфицированных HCMV клеток U251 сначала иммунопреципитировали либо анти-UL105, либо анти-UL44, либо анти-Snapin, а затем иммуноблотировали с помощью антител против UL105, UL44 и Snapin.UL105 соосаждался с эндогенным Snapin (фиг. 2, дорожки 7 и 11), в то время как мы не наблюдали значительного связывания или соосаждения между UL44 и Snapin (фиг. 2, дорожки с 1 по 6). Аналогичные результаты наблюдались также для HFF, инфицированных HCMV, и неинфицированных клеток HeLa, 293T и U251, трансфицированных pCMV-UL105 и pCMV-UL44 (данные не показаны). Эти результаты предполагают, что Snapin может специфически взаимодействовать с UL105, но не с UL44 во время инфекции HCMV.
Рис. 2Co-IP вирусных белков и клеточного Snapin в инфицированных HCMV клетках.Клетки U251 человека инфицировали HCMV (MOI = 1), и клеточные лизаты получали через 72 часа после инфицирования. Образцы входящего белка (60 мкг; входные, дорожки 3, 6, 9 и 12) и образцы (15 мкг), которые были иммунопреципитированы анти-UL44 [IP (анти-UL44), дорожки 2 и 5], анти-UL105 Антитела [IP (анти-UL105), дорожки 8 и 11] или анти-Snapin [IP (анти-Snapin), дорожки 1, 4, 7 и 10] разделяли на SDS-полиакриламидных гелях и анализировали с помощью анти-UL44. (анти-UL44), анти-UL105 (анти-UL105) и анти-Snapin (анти-Snapin) антитела соответственно.
Критические роли консервативного домена h3 спиральной спирали Snapin во взаимодействии с UL105.Snapin содержит N-концевой гидрофобный домен (аминокислоты [aa] от 1 до 20) и два консервативных домена спиральной спирали, h2 (амино кислоты 37-65) и h3 (аминокислоты 81-126) (22, 23). Было показано, что домен h3 является основным сайтом связывания для SNAP23, в то время как белки не взаимодействуют с доменом h2 (22, 23). Чтобы картировать домены Snapin, необходимые для взаимодействия с UL105, мы сконструировали серию усеченных мутантов Snapin для двухгибридных анализов дрожжей (рис.3). Кроме того, мы сгенерировали серию экспрессионных конструкций млекопитающих (таблица 1), которые кодировали мутанты усечения Snapin с тегами FLAG (рис. 3). Эти конструкции затем котрансфицировали с pCMV-UL105 в клетки U251, и взаимодействия между UL105 и различными мутантами Snapin, меченными FLAG, исследовали в экспериментах по коиммунопреципитации (фиг. 4). Результаты, обобщенные на фиг.3, показывают, что делеция домена h3 [например, в мутанте SΔh3 (81-126aa)] устраняет способность Snapin взаимодействовать с UL105, в то время как делеция каждой из оставшихся областей (например,g., аминоконцевой гидрофобный участок и домен h2) не влияли на связывание Snapin с UL105 (фиг. 4). Таким образом, консервативная последовательность h3 Snapin важна для его взаимодействия с UL105.
Рис. 3Схематическая диаграмма Snapin и его делеционных мутантов, которые взаимодействуют с UL105 и UL70, как было идентифицировано дрожжевым двугибридным (YTH) скринингом и ко-IP в клетках U251. + и -, положительные и отрицательные взаимодействия, соответственно, в двугибридном экране или со-IP.
Рис. 4Идентификация взаимодействия между UL105 и различными мутантами Snapin, помеченными FLAG, по ко-IP.Клетки U251 человека котрансфицировали pCMV-UL105 и плазмидой, экспрессирующей FLAG-меченый белок Snapin с различными мутациями. Клеточные лизаты получали через 48 часов после трансфекции. Образцы входящего белка (50 мкг) (входные, дорожки с 1 по 8) и образцы (10 мкг), которые были иммунопреципитированы анти-UL105 [IP (анти-UL105), дорожки 9–16), разделяли на SDS-содержащих полиакриламидных гелях. и анализировали с помощью антител против FLAG (anti-FLAG).
Клеточная локализация UL105 и Snapin в клетках человека.Если UL105 связан (или связывается с) Snapin в клетках, ожидается, что эти белки будут локализоваться в одних и тех же клеточных компартментах. Микроскопический анализ показал, что как Myc-tagged UL105, так и FLAG-tagged Snapin были преимущественно локализованы в цитоплазме в клетках U251, трансфицированных конструкциями (фиг. 5a-d). Для дальнейшего подтверждения этих результатов и исследования клеточной локализации немеченых белков UL105 и эндогенных белков Snapin клетки трансфецировали pCMV-UL105, который содержал последовательность, кодирующую немаркированный UL105, а затем окрашивали антителами против UL105 и против Snapin.Подобно результатам, полученным с мечеными белками (фиг. 5a-d), было обнаружено, что как UL105, так и Snapin преимущественно локализованы в цитоплазме (фиг. 5e-h). Мы также наблюдали цитоплазматическую локализацию этих двух белков в клетках HeLa и HFF (данные не показаны). Анти-UL105 оказался специфичным, поскольку окрашивание этим антителом наблюдалось только в клетках, трансфицированных pCMV-UL105, а не в пустом векторе pCDNA3.1 (+) (фиг. 5i-l). Локализация UL105 может не полностью перекрывать локализацию Snapin, возможно, потому, что оба белка динамически экспрессируются в клетках, а избыточная экспрессия UL105 может приводить к неправильному распределению небольшого количества UL105 в этих клетках.В соответствии с нашими результатами двухгибридных скринингов и экспериментов по совместному IP, эти результаты предполагают, что последовательности тегов в Myc-UL105 и FLAG-Snapin не влияют на взаимодействие и совместную локализацию UL105 со Snapin и что Snapin может специфически взаимодействовать с UL105. . Кроме того, эти результаты предоставляют прямые доказательства того, что UL105 преимущественно локализуется в цитоплазматическом компартменте неинфицированных клеток.
Рис. 5Совместная локализация UL105 и Snapin, экспрессированных в клетках человека.Клетки котрансфицировали конструкциями pCMV-Myc-UL105 и pRK11-FLAG-Snapin (от a до d), отдельно от pCMV-UL105 (от e до h) или только pCDNA3.1 (+) (от i до l), фиксированных через 48 часов. посттрансфекция, окрашивание антителами DAPI (a, e и i), anti-FLAG (b), anti-Myc (c), anti-Snapin (f и j) и анти-UL105 (g и k) и визуализация с помощью конфокального микроскопа (Olympus FV1000). Изображения Snapin (b, f и j), UL105 (c, g и k) и ядер, окрашенных DAPI (a, e и i), были использованы для создания составных изображений (d, h и l). .На изображениях показаны разные уровни увеличения.
Модуляция клеточной локализации UL105 за счет повышения и подавления экспрессии Snapin. Поскольку синтез вирусной ДНК происходит в ядрах во время инфекции HCMV, UL105, основная геликаза, должна быть локализована в ядерном компартменте. Наши результаты о том, что UL105 взаимодействует с цитоплазматическим белком Snapin и преимущественно локализуется в цитоплазме неинфицированных клеток, повышают вероятность того, что Snapin может изолировать UL105 и влиять на его клеточную локализацию посредством связывания.Если это так, ожидается, что UL105 будет накапливаться в клетках, которые сверхэкспрессируют Snapin или мутант Snapin с активностью связывания UL105, но не мутант, не проявляющий связывания с UL105. Чтобы изучить влияние сверхэкспрессии Snapin на клеточную локализацию UL105, мы сконструировали клеточную линию U251, U251-S, которая конститутивно экспрессировала полноразмерный белок Snapin, и контрольную клеточную линию, U251-C, которая содержала пустую экспрессию вектор. Кроме того, мы создали две дополнительные клеточные линии, U251-SΔh2 и U251-SΔh3, которые экспрессировали мутанты Snapin SΔh2 (37-65aa) и SΔh3 (81-126aa) соответственно.SΔh2 (37-65aa) содержал делецию консервативного спирального домена h2 (аминокислоты от 37 до 65) и был способен связываться с UL105 в дрожжевых двухгибридных анализах и экспериментах по коиммунопреципитации в клетках U251, в то время как SΔh3 (81-126aa) содержал делеция консервативного спирального домена h3 (аминокислоты с 81 по 126) и отсутствие связывания с UL105 (фиг. 3). Вестерн-блоттинг лизатов инфицированных HCMV клеток показал ~ 5-кратное повышение уровня белка Snapin в клетках, экспрессирующих Snapin и его мутанты, по сравнению с уровнями в родительских клетках U251 и контрольных клетках U251-C (рис.6). Сконструированные клеточные линии и родительские клетки U251 были неотличимы с точки зрения их роста и жизнеспособности в течение 3 месяцев (данные не показаны), что позволяет предположить, что сверхэкспрессия Snapin не приводила к значительной цитотоксичности.
Рис. 6Экспрессия Snapin и его мутантов в клетках. Вестерн-блоттинг был использован для определения уровней Snapin, UL70 и UL105 в родительских клетках U251 (U251) (дорожки 1 и 5), клетках, которые экспрессировали полноразмерный Snapin (U251-S; дорожки 2 и 6), и Мутанты Snapin SΔh2 (37-65aa) (U251-SΔh2; дорожки 3 и 7) и SΔh3 (81-126aa) (U251-SΔh3; дорожки 4 и 8).Клетки либо трансфицировали молекулами h3-siRNA против Snapin (дорожки 2–4), либо не трансфицировали никакими siRNA (дорожки 1 и 5–8) и либо ложно инфицировали (дорожка 1), либо инфицировали HCMV при MOI 1 через 48 ч инкубации миРНК (дорожки 2-8). Экспрессию клеточного актина использовали в качестве контроля внутренней нагрузки.
Чтобы изучить локализацию UL105 в инфицированных HCMV клетках, мы трансфицировали сконструированные клеточные линии pCMV-Myc-UL105, а затем инфицировали эти клетки HCMV.Мы использовали MOI от 1 до 5, чтобы гарантировать, что большинство клеток было инфицировано. Действительно, экспрессия IE1 была обнаружена в большинстве клеток, когда клетки были окрашены антителом против IE1 (данные не показаны). Инфекция HCMV, по-видимому, способствует ядерному импорту UL105 в клетки U251, поскольку мы обнаружили значительное количество сигнала UL105 в ядрах через 48-72 часа после инфицирования по сравнению с таковым в неинфицированных клетках (сравните рис. 7a-c с рис. 5). ). В присутствии инфекции HCMV локализация UL105 в клетках U251-S значительно отличалась от таковой в родительских клетках U251 и контрольных клетках U251-C.Через 48 часов после инфицирования UL105 локализовался исключительно в цитоплазме клеток U251-S (96% цитоплазматических против 4% ядерных) (фиг. 7d-f; таблица 2). Напротив, UL105 был распределен как в цитоплазме, так и в ядрах клеток U251 и U251-C (60% ядер против 40% цитоплазматических) (рис. 7a-c; таблица 2). Аналогичные результаты также наблюдались, когда клетки трансфицировали pCMV-UL105 вместо pCMV-Myc-UL105 и окрашивали антителом против UL105 (таблица 2), что согласуется с нашими наблюдениями, что последовательность метки не влияет на взаимодействие и совместную локализацию UL105. со Snapin (рис.1, 2 и 5).
Рис. 7Влияние измененной экспрессии Snapin и его мутантов на клеточное распределение UL105. Клеточная локализация UL105 в родительских клетках U251 (U251; от a до c), клетках, сверхэкспрессирующих полноразмерный белок Snapin (U251-S; от d до f), мутантах SΔh2 (37-65aa) (U251-SΔh2; от g до i) и SΔh3 (81-126aa) (U251-SΔh3; j к l) или обработанные анти-Snapin h3-siRNA клетки U251-S (h3-siRNA U251-S; m к o). Клетки трансфицировали pCMV-Myc-UL105 в отсутствие и в присутствии миРНК, инфицировали HCMV (MOI = 5) через 48 часов после трансфекции, фиксировали через 48 часов после заражения, окрашивали антителами и визуализировали с помощью конфокального микроскопа (Olympus FV1000). .Изображения ядер, окрашенных DAPI (синий) (a, d, g, j, m) и Myc-tagged UL105 (зеленый) (b, e, h, k, n), были использованы для создания составных изображений (c , f, i, l, o). На изображениях показаны разные уровни увеличения.
Таблица 2Процентное содержание UL105, локализованного в ядрах или цитоплазме a
Локализация UL105 в клетках U251-SΔh2, которые экспрессировали мутантный SΔh2 (37-65aa), проявляющий активность связывания UL105, была исключительно в цитоплазме и был подобен таковому в клетках U251-S (рис.От 7g до i; Таблица 2). Напротив, локализация UL105 в клетках U251-SΔh3, которые экспрессировали мутантный SΔh3 (81-126aa), не проявляющий активности связывания UL105, была как цитоплазматической, так и ядерной и была аналогична таковой в клетках U251 и U251-C (рис. 7j). к l; таблица 2). Эти результаты предполагают, что сверхэкспрессия Snapin приводит к снижению ядерного импорта UL105 и накоплению UL105 в цитоплазме и что связывание Snapin необходимо для наблюдаемого изменения клеточного распределения UL105.
Ожидается, что подавление экспрессии Snapin может способствовать ядерному импорту UL105, на основании наших наблюдений, что избыточная экспрессия Snapin ведет к цитоплазматическому накоплению UL105. Чтобы определить, так ли это, мы котрансфицировали различные клетки молекулами pCMV-Myc-UL105 и siRNA, которые были сконструированы либо для распознавания области мРНК Snapin, кодирующей домен h3 (h3-siRNA), либо для не распознавания каких-либо вирусных или клеточных транскриптов. (контрольная миРНК или C-миРНК), а затем либо имитировать инфицированные, либо инфицированные эти клетки HCMV через 48 часов после трансфекции.Предыдущие исследования показали, что подавление экспрессии Snapin, опосредованное siRNA, не влияет на жизнеспособность клеток (22, 24). Уровень белка Snapin был снижен более чем на 90% в различных клетках, трансфицированных h3-миРНК по сравнению с таковым в клетках, которые либо не были трансфицированы никакими миРНК, либо трансфицированы контрольной C-миРНК (рис. 6; сравните дорожки 2, 5). , и 6). При наличии инфекции HCMV UL105 преимущественно локализовался в ядрах клеток, обработанных h3-миРНК (92% ядерных против 8% цитоплазматических), но распределялся как в ядрах, так и в цитоплазме необработанных и контрольных клеток, обработанных миРНК. (60% ядер против 40% цитоплазматических) (рис.7м до o; Таблица 2).
Эффект h3-siRNA, нацеленный на область мРНК, кодирующую домен h3, оказался специфическим. Обработка клеток U251-SΔh2 h3-siRNA ингибировала экспрессию эндогенного полноразмерного снэпина и мутанта SΔh2 (37-65aa), который содержал делецию в домене h2 и проявлял активность связывания UL105 (рис. 6, дорожка 3). . В клетках U251-SΔh3 обработка h3-siRNA ингибировала экспрессию эндогенного полноразмерного снэпина, но не оказывала значительного влияния на экспрессию мутанта SΔh3 (81-126aa), который содержал делецию домена h3 и не проявлял активности связывания UL105. (полоса 4).При обработке h3-миРНК накопление ядерного UL105 наблюдалось как в клетках U251-SΔh2, так и в клетках U251-SΔh3 (таблица 2). Эти результаты предполагают, что лечение h3-siRNA подавляет экспрессию Snapin за счет связывания с его мРНК-мишенью, что приводит к снижению цитоплазматического накопления UL105 и увеличению его ядерной локализации.
Чтобы подтвердить влияние экспрессии Snapin на локализацию UL105, мы определили распределение UL105 с помощью фракционирования клеток и вестерн-блоттинга (рис.8). Вестерн-блоттинг подтвердил измененные уровни экспрессии Snapin в этих клетках (фиг. 6; данные не показаны). Инфицированные клетки подвергали дифференциальному центрифугированию на ядерную и цитоплазматическую фракции. Чистоту фракций подтверждали иммуноблоттингом на гистон h2 (ядерный маркер) и актин (цитоплазматический маркер) (фиг. 8). В родительских клетках U251, инфицированных HCMV, 60% UL105 было обнаружено в ядрах, а 40% – в цитоплазме (фиг. 8, нижний набор гелей, дорожки 4 и 11).Аналогичные результаты были также обнаружены в контрольных клетках, которые либо содержали пустой вектор экспрессии (клетки U251-C), либо были обработаны молекулами миРНК, сконструированными так, чтобы не распознавать какие-либо вирусные или клеточные транскрипты (C-миРНК) (рис. 8, нижний набор гелей). ). Подавление экспрессии Snapin приводило к увеличению (более чем 95%) уровня UL105 в ядерных фракциях клеток, обработанных h3-siRNA (фиг. 8, дорожки с 8 по 10). Напротив, менее 5% UL105 было обнаружено в ядерных фракциях в клетках, сверхэкспрессирующих полноразмерный белок Snapin и мутант Snapin SΔh2 (37-65aa), которые способны связываться с UL105 (i.е., ячейки U251-S и U251-SΔh2 соответственно; дорожки 14 и 13 соответственно), но не в клетках, экспрессирующих мутант Snapin SΔh3 (81-126aa), который не проявляет активности связывания UL105 (т.е. клетки U251-SΔh3; дорожка 12). Эти наблюдения подтверждают наши результаты микроскопических экспериментов (Таблица 2) и предполагают, что Snapin играет важную роль в клеточной локализации UL105.
Рис. 8Влияние измененной экспрессии Snapin и его мутантов на ядерное и цитоплазматическое распределение UL105.Различные клетки (например, родительские клетки U251, клетки со сверхэкспрессией Snapin и его мутанты [U251-S, U251-Δh2 и U251-Δh3]) были трансфицированы молекулами h3-siRNA против Snapin (дорожки 1-3 и 8-10. ) или не трансфицированы какими-либо миРНК (дорожки с 4 по 7 и с 11 по 14). Клетки инфицировали HCMV (MOI = 1) через 48 часов трансфекции, собирали через 48-72 часа после инфицирования и разделяли на ядерную и цитоплазматическую фракции. (Верхние три панели) Эквивалентные количества каждой фракции анализировали с помощью иммуноблоттинга с анти-UL105 и анти-UL70, в то время как чистоту ядерной и цитоплазматической фракций оценивали иммуноблоттингом с антигистоном h2 и антиактином, соответственно.(Внизу) Анализы повторяли три раза, и стандартные отклонения обозначены полосами погрешностей.
Модуляция клеточной локализации UL105 с помощью Snapin не зависит от его взаимодействия с UL70 HCMV. Недавно мы показали, что Snapin также специфически взаимодействует с примазой UL70 HCMV и что повышающая и понижающая регуляция экспрессии Snapin приводит к накоплению белка UL70 в цитоплазме. и ядра соответственно (21). Поскольку UL70 образует комплекс примаза-геликаза с UL105 во время инфекции HCMV, возможно, что наблюдаемая модуляция клеточной локализации UL105 с помощью Snapin опосредуется его взаимодействием с UL70.Однако три линии доказательств предполагают, что это маловероятно и что модуляция локализации UL105 с помощью Snapin не зависит от его взаимодействия с UL70.
Во-первых, чтобы определить, может ли Snapin связываться с UL105 независимо от UL70, были проведены двухгибридные тесты дрожжей и эксперименты по совместному IP, чтобы изучить, может ли UL70 взаимодействовать с мутантами Snapin, полученными в этом исследовании. Результаты, обобщенные на фиг.3, показывают, что (i) консервативная последовательность h2 Snapin важна для его взаимодействия с UL70 и (ii) мутанты SΔh2 (37-65aa) и SΔh3 (81-126aa) с делецией разные консервативные домены h2 и h3, соответственно, не смогли взаимодействовать с UL70 и UL105, соответственно, предполагая, что Snapin может связываться с UL105 независимо от UL70.Эти результаты согласуются с нашими наблюдениями за взаимодействием Snapin и UL105 в отсутствие инфекции UL70 и HCMV (рис. 1, 3 и 5).
Во-вторых, влияние модуляции экспрессии Snapin на локализацию UL105 оказалось независимым от взаимодействия Snapin с UL70. В инфицированных HCMV клетках U251-S, U251-SΔh2 и U251-SΔh3, экспрессирующих Snapin и его мутанты SΔh2 (37-65aa) и SΔh3 (81-126aa), соответственно, общие клеточные уровни UL70 и UL105 были аналогичны таковым. показано в западном анализе (рис.6). Однако по сравнению с уровнями в родительских клетках U251 уровни UL70, но не UL105, были увеличены в цитоплазме и уменьшились в ядрах клеток U251-SΔh3, которые экспрессировали SΔh3 (81-126aa) и которые были способны связываться с UL70, но не UL105 (рис. 8, дорожки 5 и 12). Напротив, уровни UL105, но не UL70, увеличивались в цитоплазме и снижались в ядрах клеток U251-SΔh2, которые экспрессировали SΔh2 (37-65aa) и которые были способны связываться с UL105, но не с UL70 (рис.8, дорожки 6 и 13). Как и ожидалось, накопление UL70 и UL105 было обнаружено в цитоплазме клеток U251-S, экспрессирующих полноразмерный Snapin из-за его взаимодействия с этими двумя белками HCMV (фиг. 8, нижний набор гелей, дорожки 7 и 14). Эти результаты предполагают, что Snapin может модулировать клеточную локализацию UL105 без взаимодействия с UL70 и наоборот.
В-третьих, представление о том, что Snapin модулирует клеточную локализацию UL105 независимо от его взаимодействия с UL70, дополнительно подтверждается нашими экспериментами по siRNA, подавляющими экспрессию Snapin и его делеционных мутантов.Общие клеточные уровни UL70 и UL105 в клетках, обработанных h3-миРНК, были аналогичны уровням UL70 и UL105 в клетках, которые не были обработаны или обработаны контрольной миРНК, соответственно (фиг. 6; данные не показаны). Снижение экспрессии Snapin в обработанных h3-миРНК клетках U251-S и U251-SΔh2, по-видимому, приводило к увеличению ядерного импорта UL105 и UL70 (фиг. 8, дорожки 2 и 3 и дорожки 9 и 10). В обработанных h3-миРНК клетках U251-SΔh3 сверхэкспрессия мутантного SΔh3 (81-126aa), на экспрессию которого не влияет h3-миРНК из-за отсутствия последовательности целевого домена h3, приводила к увеличению Уровень UL70 в цитоплазме (дорожки 1 и 8).Снижение экспрессии эндогенного полноразмерного белка Snapin привело к увеличению UL105 в ядрах даже в присутствии сверхэкспрессированного SΔh3 (81-126aa), поскольку этот мутант не связывается с UL105 (рис. 8, дорожки 1 и 8). ). Таким образом, UL70 и UL105, по-видимому, накапливаются в цитоплазме и ядрах, соответственно, в обработанных h3-siRNA клетках U251-SΔh3, что согласуется с нашим представлением о том, что Snapin взаимодействует с UL105 и модулирует его клеточную локализацию независимо от его взаимодействия с UL70.
Влияние взаимодействия UL105 на Snapin на синтез ДНК HCMV и литическую инфекцию. Ожидается, что изменение уровня UL105 в ядре в результате измененной экспрессии Snapin может повлиять на уровень синтеза ДНК HCMV и литическую инфекцию. . Чтобы определить влияние измененной экспрессии Snapin на инфекцию HCMV, мы исследовали профили экспрессии вирусных генов путем анализа продукции вирусных белков различных кинетических классов во время репликации в клетках, где экспрессия Snapin была изменена.
Различные клетки инфицировали HCMV, а затем собирали через несколько временных точек после заражения. Вестерн-блоттинг подтвердил измененные уровни экспрессии Snapin в этих клетках (фиг. 6; данные не показаны). Например, через 48-72 часа после инфицирования в клетках U251-S и U251-SΔh2, обработанных молекулами h3-миРНК, было обнаружено снижение более чем на 90% экспрессии Snapin и его делеционного мутанта, в то время как уровни Snapin и его делеционные мутанты в клетках U251-S, U251-SΔh2 и U251-SΔh3 были примерно в 5 раз выше, чем в клетках U251 (рис.6; данные не показаны). Повышающая и понижающая регуляция экспрессии Snapin или его делеционных мутантов, по-видимому, не влияла на уровни белка как продукта раннего вирусного гена IE1, так и продукта раннего гена UL44 (фиг. 9A). Однако снижение уровня белка гликопротеина H (gH) было обнаружено в клетках, которые демонстрировали сверхэкспрессию уровней Snapin и его мутантов (т.е. клетки U251-S, U251-SΔh2, U251-SΔh3 и U251-SΔh3, обработанные h3-siRNA), тогда как повышение уровня gH было обнаружено в клетках, которые демонстрировали более низкие уровни Snapin и его мутантов (т.е.например, клетки U251-S и U251-SΔh2, обработанные h3-миРНК) (фиг. 9A). Гликопротеин H является продуктом вирусного позднего гена, экспрессия которого зависит от синтеза вирусной ДНК (1). Мы предположили, может ли изменение уровней gH в этих клетках быть эффектом модуляции синтеза вирусной ДНК в результате изменения ядерных уровней UL105, а также уровня UL70 из-за измененной экспрессии Snapin.
Рис. 9Влияние измененной экспрессии Snapin на экспрессию гена HCMV и вирусный геномный синтез и продукцию.(A) Вестерн-блоттинг был использован для анализа уровней HCMV IE1, UL44 и gH в родительских клетках U251 (U251; дорожки 4, 11, 18 и 25), клетках, сверхэкспрессирующих полноразмерный Snapin (U251-S; дорожки 3, 7, 10, 14, 17, 21, 24 и 28) и мутанты Snapin SΔh2 (37-65aa) (U251-Δh2; дорожки 2, 6, 9, 13, 16, 20, 23 и 27 ) и SΔh3 (81-126aa) (U251-SΔh3; дорожки 1, 5, 8, 12, 15, 19, 22 и 26). Клетки были либо трансфицированы анти-Snapin h3-siRNA (h3-siRNA; дорожки 1–3, 8–10, 15–17 и 22–24), либо не трансфицировались никакими siRNA (дорожки 4–7, 11–14, 18-21 и 25-28), инфицированные HCMV при MOI 1 через 48 часов после трансфекции и собираемые через 48-72 часа после заражения.Экспрессию клеточного актина использовали в качестве контроля внутренней нагрузки. (B) Для анализа уровня внутриклеточной вирусной ДНК клетки собирали через 72 часа после заражения. (C) Общие инфицированные культуры собирали через 5 дней после инфицирования и определяли титры вирусов. Значения относительных титров HCMV и уровней ДНК, которые являются средними из трех независимых экспериментов, представляют собой отношения вирусных титров или уровней ДНК в различных клетках к таковым в родительских клетках U251 (U251), соответственно.Вирусные титры в родительских клетках U251 составляли 5 × 10 4 БОЕ / мл. Анализы повторяли трижды, и стандартные отклонения обозначены полосами ошибок.
Две серии экспериментов были проведены в этих ячейках, чтобы определить, так ли это. В первой серии экспериментов была выделена общая внутриклеточная ДНК и проанализированы уровни синтеза вирусной ДНК. Число вирусных геномов, присутствующих в каждом образце, определяли с помощью количественной ПЦР в реальном времени (кПЦР) с числом копий вирусной последовательности UL83, нормализованной к числу копий последовательности клеточного гена β-актина.Через 72 часа после инфицирования наблюдалось снижение более чем на 90% количества копий UL83 / β-актина в клетках, которые демонстрировали сверхэкспрессию уровней Snapin и его мутантов (например, U251-S, U251-SΔh2, U251-SΔh3 и клетки U251-SΔh3, обработанные h3-миРНК), тогда как увеличение примерно в 3,5–4 раза было обнаружено в клетках, которые демонстрировали более низкие уровни Snapin и его мутантов (т. е. обработанные h3-миРНК клетки U251-S и U251-SΔh2 клетки) (рис. 9Б). Напротив, не было обнаружено значительной разницы в количестве копий UL83 / β-актина между родительскими клетками U251 и клетками U251-C, содержащими пустой вектор экспрессии, или клетками, обработанными молекулами C-миРНК (рис.9Б). Эти результаты предполагают, что измененная экспрессия мутантов Snapin, которые специфически взаимодействуют с UL70 [например, SΔh3 (81-126aa)] и UL105 [например, SΔh2 (37-65aa)] независимо модулируют синтез ДНК HCMV.
Во второй серии экспериментов определяли продукцию вирусного потомства в этих клетках. Запасы вирусов готовили из инфицированных культур (клеток и культуральной среды вместе) и определяли их титры. Через 5 дней после заражения наблюдалось снижение вирусного выхода по крайней мере в 20 раз в клетках, которые демонстрировали сверхэкспрессию уровней Snapin и его мутантов (т.е.е., U251-S, U251-SΔh2, U251-SΔh3 и обработанные h3-siRNA клетки U251-SΔh3), тогда как увеличение примерно в 5 раз было обнаружено в клетках, которые демонстрировали более низкие уровни Snapin и его мутантов (т. е. , обработанные h3-миРНК клетки U251-S и U251-SΔh2) (фиг. 9C). Напротив, не было обнаружено значительной разницы в выходе вируса между родительскими клетками U251 и клетками U251-C, содержащими пустой вектор экспрессии, или клетками, обработанными молекулами C-siRNA (фиг. 9C). Эти результаты предполагают, что измененная экспрессия мутантов Snapin SΔh2 (37-65aa) и SΔh3 (81-126aa), которые специфически взаимодействуют с UL105 и UL70, соответственно, независимо модулируют литическую репликацию и продукцию вируса.
ОБСУЖДЕНИЕ
В этом исследовании мы предоставляем первое прямое доказательство того, что белок UL105 HCMV специфически взаимодействует с человеческим Snapin. Snapin – это высококонсервативный и преимущественно цитоплазматический белок, который повсеместно экспрессируется во многих типах клеток, таких как адипоциты и нейрональные клетки (22-24). Этот белок функционирует как компонент комплекса белков SNARE, который необходим для стыковки и слияния синаптических пузырьков в нейрональных клетках (23). Snapin также обнаруживается в других типах клеток для взаимодействия с компонентами биогенеза связанного с лизосомами комплекса органелл 1 (BLOC-1), который представляет собой повсеместно экспрессируемый мультисубъединичный белковый комплекс, необходимый для нормального биогенеза специализированных органелл эндосомно-лизосомальной системы. , такие как меланосомы и плотные тромбоциты гранулы (35, 36).Наши результаты предполагают, что специфическое взаимодействие Snapin изолирует UL105 в цитоплазме и снижает его ядерный импорт, что приводит к ингибированию синтеза ДНК HCMV и продукции частиц. Было бы интересно исследовать, является ли такое ингибирование, опосредованное взаимодействием Snapin с UL105, противовирусной защитой в пользу хозяина или представляет собой средство сдерживания вируса (28) в пользу HCMV, который хорошо известен своей способностью контролировать его репликацию строго регулируемым образом во время хронических и латентных инфекций.Регулирование репликации вирусной геномной ДНК без воздействия на немедленную раннюю и раннюю экспрессию генов представляет собой средство для персистирующей вирусной инфекции и играет важную роль в вирусном патогенезе. Наши результаты исследований влияния Snapin на клеточную локализацию UL105 предполагают новый механизм регулирования клеточного распределения гомологов геликазы в других герпесвирусах, приводящий к модуляции репликации / роста вирусной ДНК.
Наши выводы о взаимодействии UL105-Snapin могут иметь общие последствия в отношении путей локализации и сборки компонентов механизма репликации ДНК герпесвирусов.Каждый компонент трехкомпонентного комплекса геликаза-примаза высококонсервативен у всех герпесвирусов (1, 37, 38). Например, комплекс геликаза-примаза в HSV-1 кодируется UL52 (геликаза), UL5 (примаза) и UL8 (фактор, связанный с примазой), а в KSHV кодируется ORF44 (геликаза), ORF56 (примаза). и ORF40 / 41 (фактор, ассоциированный с примазой), тогда как у EBV кодируется BBLF (геликаза), BSLF1 (примаза) и BBLF2 / 3 (фактор, ассоциированный с примазой) (11, 12, 39–41). Обычно считается, что процесс правильной локализации комплекса геликаза-примаза в ядрах, месте синтеза вирусной ДНК, является консервативным среди всех герпесвирусов (1).В EBV при индивидуальной экспрессии в клетках человека BBLF, BSLF1 и BBLF2 / 3 локализовались в цитоплазме (12). Однако, когда все три были экспрессированы в одних и тех же клетках, эти белки локализовались в ядрах. Аналогичные результаты наблюдались также при локализации UL5, UL8 и UL52 HSV-1 (11, 13, 42). В KSHV при индивидуальной экспрессии в клетках ORF56 (примаза), ORF44 и ORF40 / 41 были локализованы в цитоплазме (41). Однако эти три белка были локализованы в ядрах только тогда, когда они были коэкспрессированы с другими основными компонентами аппарата репликации вирусной ДНК, включая ДНК-полимеразу, фактор процессивности полимеразы и одноцепочечный ДНК-связывающий белок (41).Было показано, что UL105 взаимодействует с UL70 и UL102 (8). Однако в настоящее время мало что известно о том, как UL105 (и его аналоги в других вирусах) взаимодействуют с UL70 и UL102 (и их аналогами в других вирусах) для достижения надлежащей локализации в ядрах. О клеточных факторах, которые взаимодействуют с UL105, не сообщалось. В этом исследовании мы представляем первое прямое доказательство того, что UL105, когда он экспрессируется отдельно в клетках человека, локализуется исключительно в цитоплазме (рис. 5). Это согласуется с паттерном цитоплазматической локализации его аналогов при HSV, EBV и KSHV, который был обнаружен, когда эти белки экспрессировались по отдельности в отсутствие других вирусных белков (11, 12, 39–41).Кроме того, мы впервые показали, что UL105 специфически взаимодействует со Snapin, который преимущественно локализован в цитоплазме. Snapin может играть ключевую роль в клеточной локализации UL105, связываясь с этим белком и секвестрируя его в цитоплазматическом компартменте. Взаимодействует ли Snapin с аналогами UL105 в других вирусах, в настоящее время неизвестно. Наши результаты показывают, что консервативный домен h3 спиральной спирали Snapin важен для его связывания с UL105. Будет интересно определить, необходим ли этот домен также для взаимодействия Snapin с белками геликазы других герпесвирусов.
Наши эксперименты по совместному IP показали, что UL105 потенциально взаимодействует со Snapin в нескольких различных типах клеток, таких как клетки U251, U373MG и 293T, фибробласты крайней плоти и клетки HeLa. Кроме того, мы исследовали роль Snapin в локализации UL105 и инфекции HCMV в клетках U251. Клетки U251 были получены из нервных тканей, которые естественным образом могут быть инфицированы HCMV in vivo , и были использованы для изучения инфекции HCMV (1). Дальнейшие эксперименты на фибробластах и других клетках, допускающих инфекцию HCMV, должны прояснить роль Snapin в этих клетках.
Недавно мы показали, что Snapin также специфически взаимодействует с примазой UL70 HCMV и модулирует ее клеточную локализацию (21). Учитывая тот факт, что известно, что UL70 образует комплекс примаза-геликаза с UL105 во время инфекции HCMV, возможно, что наблюдаемая модуляция клеточной локализации UL105 с помощью Snapin опосредуется его взаимодействием с UL70. Однако несколько линий доказательств предполагают, что это маловероятно и что модуляция локализации UL105 с помощью Snapin происходит через специфическое взаимодействие Snapin с UL105 и не зависит от его взаимодействия с UL70.Во-первых, взаимодействие Snapin-UL105 было идентифицировано как дрожжевыми двугибридными анализами, так и экспериментами по совместному IP в клетках человека в отсутствие экспрессии UL70 (рис. 1, 3 и 5). Во-вторых, разные домены Snapin необходимы для взаимодействия с UL70 и UL105. Мутант Snapin SΔh3 (81-126aa) с делецией консервативного домена h3, связанный с UL70, но не с UL105, в то время как мутантный SΔh2 (37-65aa) с делецией другого домена h2, связанный с UL105, но не с UL70. В-третьих, Snapin может модулировать клеточную локализацию UL105 в отсутствие его взаимодействия с UL70 и наоборот.По сравнению с уровнями в родительских клетках U251, уровни UL105, но не UL70, были увеличены в цитоплазме и уменьшились в ядрах клеток U251-SΔh2, которые экспрессировали SΔh2 (37-65aa), который способен связываться с UL105, но не UL70 (рис. 8). В-четвертых, измененная экспрессия мутантов Snapin, которые специфически взаимодействуют с UL105 [например, SΔh2 (37-65aa)] и UL70 [например, SΔh3 (81-126aa)] независимо модулируют синтез ДНК HCMV и продукцию потомства вируса, соответственно (рис. 9) .
В дополнение к кодирующей последовательности Snapin, кодирующие последовательности нескольких белков человека также были идентифицированы как присутствующие в дрожжевых колониях, которые были положительными в экспериментах по скринингу с двумя гибридами дрожжей UL105.Дополнительные и независимые эксперименты (например, коиммунопреципитация) будут выполнены для подтверждения взаимодействия этих белков с UL105. Дальнейшие исследования этих потенциальных взаимодействий дадут представление о том, как белки-хозяева модулируют функцию UL105 при инфекции HCMV.
Возможно, что Snapin взаимодействует с белками HCMV, отличными от UL105 и UL70, что приводит к модуляции репликации вирусной ДНК, как это наблюдалось в наших экспериментах. Однако наши эксперименты с двумя гибридами дрожжей не выявили положительного взаимодействия между Snapin и более чем 100 ORF HCMV, кроме UL105 и UL70 (данные не показаны).Эксперименты по Co-IP с использованием антител против нескольких белков HCMV, которые в настоящее время коммерчески доступны (например, UL44, IE1 и UL83), не выявили каких-либо положительных взаимодействий (рис. 2; данные не показаны). Кроме того, мутант Snapin с делецией домена h2 [т.е. SΔh2 (37-65aa)] взаимодействовал только с UL105, а не с другими протестированными белками HCMV. Хотя мы не можем полностью исключить возможность того, что Snapin может влиять на репликацию ДНК HCMV, взаимодействуя с белками HCMV, отличными от UL105 и UL70, наши результаты для ложно-инфицированных и инфицированных HCMV клеток (например.g., рис. 5 и 7 и таблица 2) предполагают, что Snapin может взаимодействовать с UL105 и изменять его клеточную локализацию в отсутствие других белков HCMV, что, возможно, приводит к модуляции репликации вирусной ДНК во время инфекции HCMV.
Наши наблюдения показывают, что правильная клеточная локализация UL105 в цитоплазме или ядре находится в тонком балансе и может быть продиктована клеточным уровнем экспрессии Snapin. Каким образом UL105 удерживается Snapin в цитоплазме, в настоящее время неизвестно.Возможно, что Snapin изолирует UL105 в определенных цитоплазматических компартментах, так что UL105 недоступен для взаимодействия с другими вирусными или клеточными белками-носителями для ядерного транспорта. Когда экспрессия Snapin снижена, UL105 доступен для взаимодействия с клеточным ядерным транспортным белком (белками), что приводит к увеличению ядерного импорта UL105. Напротив, Snapin при сверхэкспрессии взаимодействует с UL105 и изолирует его, что приводит к его накоплению в цитоплазме. Эта гипотеза подтверждается нашими наблюдениями, что повышающая и понижающая регуляция Snapin способствует цитоплазматическому и ядерному накоплению UL105, соответственно.Было бы интересно определить, задействует ли клеточная локализация гомологов UL105 в других вирусах аналогичные клеточные пути. Эти и будущие исследования взаимодействия белков геликазы вируса герпеса с другими вирусными и клеточными белками дадут понимание механизма правильной локализации и сборки комплекса геликаза-примаза во время литической инфекции герпесвирусов.
БЛАГОДАРНОСТИ
Мы признательны Полу Райдеру, Гиа-Фонг Ву, Луяо Шао и Цзюнь Хуангу за техническую помощь и бесценные предложения.Мы также благодарим Джона Ву из Promab Inc. за отличную помощь в производстве антител.
A.S. был получателем китайской стипендии для аспирантов Министерства образования Китая (NSFC; № 30528022). E.Y. была частично поддержана докторской стипендией блочного гранта (Калифорнийский университет, Беркли). Это исследование было поддержано грантами Национальной программы фундаментальных исследований Китая (программа 973, № 2011CB504800 и 2012CB518900), Национального фонда естественных наук Китая (№31100128 и 81030031) и NIH (RO1-AI050468 и RO1-DE014145).
СНОСКИ
- Получено 19 июня 2013 г.
- Принято 15 июля 2013 г.
- Принята рукопись размещена в Интернете 24 июля 2013 г.
- Авторские права © 2013, Американское общество микробиологии. Все права защищены.
Отрицательная регуляция аутофагии посредством UBA6-BIRC6-опосредованного убиквитинирования LC3
Макроаутофагия (здесь именуемая аутофагией) – это катаболический процесс, включающий поглощение цитоплазматических материалов двухмембранными аутофагосомами, которые впоследствии сливаются с лизосомами с образованием автолизосом, где материалы разлагаются кислотными гидролазами (Bento et al., 2016; Дикич и Элазар, 2018). Субстраты аутофагии включают аномальные частицы, такие как белковые агрегаты, поврежденные органеллы и внутриклеточные патогены. Аутофагия также участвует в деградации нормальных клеточных компонентов для выживания в условиях ограничения питательных веществ или других стрессов. Благодаря этим функциям аутофагия играет решающую роль в поддержании клеточного гомеостаза. Нарушение аутофагии способствует патогенезу различных заболеваний, включая нейродегенерацию, рак, кардиомиопатии и инфекционные заболевания (Dikic and Elazar, 2018; Levine and Kroemer, 2008).
Механизм аутофагии состоит из нескольких этапов, включая индукцию клеточными сигналами, образование и экспансию фагофоров, поглощение субстрата, закрытие аутофагосом и слияние аутофагосома-лизосома (Braten et al., 2016; Dikic and Elazar, 2018). Ключевыми компонентами аппарата аутофагии являются представители семейства убиквитин (Ub) -подобных белков Atg8 (LC3A, LC3B, LC3C, GABARAP, GABARAPL1 и GABARAPL2 у млекопитающих), которые играют роль в образовании аутофагосом и слиянии аутофагосом и лизосом (Wild et al. al., 2014; Йохансен и Ламарк, 2019). Наиболее изученным представителем этого семейства является LC3B (продукт гена MAP1LC3B ), который претерпевает преобразование из растворимой цитозольной формы (LC3B-I) в конъюгированную с фосфатидилэтаноламином (PE) мембраносвязанную форму (LC3B-II. ) (Kabeya et al., 2004). LC3B-II впоследствии взаимодействует с мотивами LC3-взаимодействующей области (LIR) различных грузовых рецепторов для захвата аутофагических грузов с образованием аутофагосом (Birgisdottir et al., 2013). Среди этих рецепторов есть цитозольные белки, такие как SQSTM1 (p62), NBR1, NDP52, OPTN и TAX1BP1, которые связывают полиубиквитинированные грузы через свои Ub-связывающие домены (Birgisdottir et al., 2013; Wild et al., 2014; Йохансен и Ламарк, 2019). Другие рецепторы грузов прикреплены к аутофагическим грузам через их трансмембранные домены, как в случае BNIP3, NIX и FUNDC1 в митохондриальной аутофагии (митофагии) (Birgisdottir et al., 2013; Wild et al., 2014; Johansen and Lamark, 2019 ), а также RTN3, SEC62, CCPG1, FAM134B и TEX264 в аутофагии эндоплазматического ретикулума (ER) (ER-фагия) (Khaminets et al., 2015; Fumagalli et al., 2016; Grumati et al., 2017; Smith et al. , 2018; Chino et al., 2019; Johansen, Lamark, 2019).После слияния аутофагосом с лизосомами аутофагические грузы вместе с белками семейства Atg8 и грузовыми рецепторами деградируют в лизосомах (Tanida et al., 2005; Bjørkøy et al., 2005). Помимо участия в рекрутировании грузов в формирующуюся аутофагосому, LC3B взаимодействует с LIR-мотивом FYCO1 (FYVE и домен спиральной спирали, содержащий белок 1), который служит адаптером к двигателю кинезина-1, обеспечивая антероградный транспорт аутофагосом вдоль треки микротрубочек (Pankiv et al., 2010). Более того, LC3B взаимодействует с мотивом LIR другого адапторного белка, PLEKHM1 (домен гомологии плекстрина, содержащий член 1 семейства белков), который функционирует как связующее звено в слиянии аутофагосома-лизосома (McEwan et al., 2015).
Аппарат аутофагии регулируется посттрансляционными модификациями, такими как фосфорилирование и убиквитинирование. Некоторые киназы участвуют в позитивной или негативной регуляции аутофагии. В качестве примера положительной регуляции unc-51-подобная киназа 1, активирующая аутофагию (ULK1), фосфорилирует VPS34 (Egan et al., 2015; Russell et al., 2013), BECN1 (Russell et al., 2013) и ATG14L1 (Park et al., 2016) компоненты комплекса PI3K класса III, который впоследствии катализирует превращение фосфатидилинозитола (PI) в фосфатидилинозитол-3-фосфат. [PI (3) P], вызывая образование фагофоров. Сам ULK1 активируется фосфорилированием по Ser-317, Ser-555 и Ser-777 с помощью AMP-активированной протеинкиназы (AMPK) (Egan et al., 2011; Kim et al., 2011). С другой стороны, механистическая мишень киназы комплекса-1 рапамицина (mTOR) (mTORC1) негативно регулирует аутофагию, фосфорилируя ULK1 на Ser-757 и, таким образом, предотвращая взаимодействие ULK1 с AMPK (Kim et al., 2011). Киназа mTORC1 оказывает дополнительный ингибирующий эффект на аутофагию путем фосфорилирования белка аутофагии UVRAG, модификации, которая снижает созревание аутофагосом и слияние аутофагосом и лизосом (Kim et al., 2015).
Убиквитинирование также играет положительную и отрицательную роль в аутофагии. Фактически, некоторые из киназ или комплексов киназ, которые регулируют аутофагию, сами являются мишенями убиквитинирования. Например, ULK1 и BECN1 позитивно регулируются полиубиквитинированием, опосредованным Ub-лигазой (E3) TRAF6 (Shi and Kehrl, 2010; Nazio et al., 2013). Неферментативные компоненты аппарата аутофагии также могут положительно регулироваться посредством убиквитинирования, как в случае полиубиквитинирования OPTN с помощью E3 HACE1, которое способствует сборке OPTN с SQSTM1 и, таким образом, приводит к усиленному разрушению аутофагии (Liu et al. 2014). Примером отрицательного воздействия убиквитинирования на аутофагию является активация mTORC1 посредством TRAF6-опосредованного полиубиквитинирования каталитической субъединицы mTOR с последующим ингибированием аутофагии (Linares et al., 2013). Более того, ULK1 и компоненты комплекса PI3K класса III нацелены на полиубиквитинирование и деградацию с помощью E3 Cul3-KLHL20 (Liu et al., 2016). Наконец, BECN1 полиубиквитинируется с помощью RNF216 и NEDD4 E3s, вызывая дестабилизацию комплекса PI3K класса III (Platta et al., 2012; Xu et al., 2014).
И фосфорилирование, и убиквитинирование были нацелены на фармакологические манипуляции с аутофагией. Например, ингибирование mTORC1 препаратами рапамицин или торин1 (Noda and Ohsumi, 1998; Thoreen et al., 2009) или активация AMPK метформином (Shi et al., 2012) широко используются для стимуляции аутофагии. Напротив, ингибирование комплекса PI3K класса III с помощью вортманнина, LY294002 или 3-метиладенина нарушает аутофагию (Blommaart et al., 1997; Wu et al., 2010). Наконец, ингибирование USP10 / 13-опосредованного деубиквитинирования BECN1 с помощью spautin-1 вызывает дестабилизацию и деградацию комплекса PI3K класса III, уменьшая аутофагию (Liu et al., 2011). Стимуляция аутофагии была предложена в качестве возможной терапии нейродегенеративных расстройств, вызванных накоплением внутриклеточных белковых агрегатов (Liu et al., 2011). С другой стороны, ингибирование аутофагии может использоваться для лечения гиперпролиферативных расстройств, вызванных усилением аутофагии, как в случае некоторых видов рака (Jiang et al., 2015). Однако участие известных регуляторов аутофагии в других клеточных процессах затрудняет попытки использовать их фармакологическую активацию или ингибирование в клинических целях. Следовательно, существует потребность в идентификации дополнительных регуляторов аутофагии, которые могут быть нацелены на терапевтическое применение.
Чтобы идентифицировать дополнительные регуляторы аутофагии, мы провели скрининг нокаута CRISPR / Cas9 (KO) по всему геному с использованием клеток, которые были отредактированы для экспрессии эндогенного LC3B, меченного тандемными флуоресцентными белками GFP и mCherry.Этот скрининг основан на индуцированном кислотой тушении GFP, но не mCherry, при слиянии аутофагосом с лизосомами (Kimura et al., 2007). Мутантные клетки, демонстрирующие более высокие отношения флуоресценции GFP: mCherry, были отобраны с помощью сортировки по активации флуоресценции (FACS), а мутантные гены были идентифицированы с помощью секвенирования следующего поколения. Надежность экрана была продемонстрирована путем идентификации генов, кодирующих практически все основные компоненты аппарата аутофагии. Кроме того, мы идентифицировали других кандидатов, среди которых были два белка, связанных с убиквитинированием: Ub-активирующий фермент (E1) UBA6 и гибридный Ub-конъюгированный фермент / Ub-лигаза (E2 / E3) BIRC6.Дальнейшие анализы показали, что эти ферменты взаимодействуют, чтобы катализировать моноубиквитинирование LC3B, помечая его для деградации протеасомой. KO UBA6 или BIRC6 увеличивали уровни LC3B и уменьшали накопление агресомоподобных индуцированных структур (ALIS) в ненейрональных клетках и агрегатов α-синуклеина в нейронах. Таким образом, эти данные идентифицируют UBA6 и BIRC6 как негативные регуляторы аутофагии, ингибирование которых может быть использовано для усиления аутофагии и, таким образом, предотвращения накопления агрегатов патогенных белков.
В моем календаре нет расписания, что не так? – Планирование Acuity
Если у вас нет свободного времени, и это не из-за того, что вы хорошо зарезервированы, у нас есть несколько советов по устранению неполадок, которые могут помочь.
Советы по поиску и устранению неисправностей:
- У вас включен Look Busy и / или Minimize Gaps ? Эти настройки сокращают количество доступных назначений, которые отображаются на странице планирования клиентов.Вы можете отключить их в разделе «Ограничения расписания».
- Дата слишком далеко вперед или слишком близко к текущему дню? С помощью ограничений планирования вы можете ограничить, насколько близко (или как далеко) можно запланировать встречи. Узнайте, как изменить лимиты расписания.
- День недоступен ? Проверьте свой Календарь встреч и выберите нужный день. Недоступность может быть установлена вами или автоматически заблокирована, если включена синхронизация календаря.
- Ваш доступен слишком мало для продолжительности встречи ? Любые открытые временные интервалы должны быть достаточно длинными, чтобы соответствовать длительности встречи и любому назначенному времени заполнения.Так что, если у вас назначена 45-минутная встреча (включая заполнение), она не уместится в 30-минутный временной интервал.
- У вас встреч на временной интервал, установленный на 0 ? Если вы установили это значение в 0, все клиентское планирование запрещено. Изменив число на 1, вы можете разрешить планирование для одного клиента за раз.
- Если у вас есть классы, нет ли предстоящих классов ? Это можно исправить на главной странице календаря, щелкнув Class или перейдя в раздел Edit one of your class Appointment Types и выбрав Offer Class в правой части страницы.
Никто из них не виноват? Не беспокойтесь – у нас есть еще несколько вариантов изменить вашу доступность:
Если вы попробовали все это, а время встречи , все равно не появляются, обратитесь в службу поддержки, и мы разберемся с этим!
.