РОИ :: Законодательно вернуть нормы предельной наполняемости групп дошкольных учреждений: до 1 года – не больше 10 детей; до 3 лет – не больше 15 детей; 3-7 лет
Дефицит мест в детских садах сегодня является одной из самых острых проблем России. Однако кое-какие шаги для покрытия дефицита правительство России уже предприняло. Речь идет об изменениях в СанПиН (санитарных нормах и правилах для детских дошкольных учреждений), согласно которым группы в детских садах можно вполне официально “уплотнить”.
До 1 октября 2010 года Типовым положением о ДОУ (дошкольные образовательные учреждения), Постановлением Минтруда РФ от 21.04.1993 № 88 “Об утверждении Нормативов по определению численности персонала, занятого обслуживанием дошкольных учреждений (ясли, ясли-сады, детские сады)” и СанПиН для ДОУ были установлены достаточно жесткие условия работы детских садов. Предельно допустимое количество детей в группах было строго регламентировано, а руководство детского сада не имело права самостоятельно устанавливать режимы пребывания детей в группах. Однако 15.05.2013 главный санитарный врач России подписал Постановление № 26, согласно которому в действие вступили новые санитарные правила СанПиН 2.4.1.3049-13 «Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы дошкольных образовательных организаций».
Однако 15.05.2013 главный санитарный врач России подписал Постановление № 26, согласно которому в действие вступили новые санитарные правила СанПиН 2.4.1.3049-13 «Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы дошкольных образовательных организаций».
до 1 года – не больше 10 детей;
до 3 лет – не больше 15 детей;
3-7 лет – не больше 20 детей (оптимально 15 детей).
Согласно новым санитарным правилам норму количества детей в группе стали рассчитывать исходя из общей игровой площади (включая площадь, занятую мебелью) помещения:
для ясельных групп – не меньше 2,5 кв.м. на одного ребенка;
для дошкольных групп – не меньше 2 кв.м. на одного ребенка.
Нормы рассчитываются, исходя из площади игрового помещения. Расчет прост. Если площадь игровой комнаты составит 70 квадратных метров, то одновременно в ней могут находиться 28 ясельников или 35 воспитанников с 3 до 7 лет.
 При этом количество обслуживающего и педагогического персонала не увеличивается. Учитывается только фактический список пребывания детей в садике в данный момент, по списку их может быть 45–49. Еще одним новшеством в нормативном документе стало разрешение на переоборудование игрового помещения на время сонного часа в спальню. Детский сад приобретает раскладушки, воспитатели расставляют их в игровой комнате для тех, кому стационарных кроватей не хватает. После сна оборудование убирается, игровая зона свободна. Стоит учитывать, что 2 или 2,5 квадратных метра на ребенка — это условный показатель. По факту игровая комната выполняет роль столовой, учебного помещения. Здесь стоят столы, стулья, игрушки, методическое оборудование. То есть половина зала занята мебелью. Таким образом, остается 50 процентов площади.
При этом количество обслуживающего и педагогического персонала не увеличивается. Учитывается только фактический список пребывания детей в садике в данный момент, по списку их может быть 45–49. Еще одним новшеством в нормативном документе стало разрешение на переоборудование игрового помещения на время сонного часа в спальню. Детский сад приобретает раскладушки, воспитатели расставляют их в игровой комнате для тех, кому стационарных кроватей не хватает. После сна оборудование убирается, игровая зона свободна. Стоит учитывать, что 2 или 2,5 квадратных метра на ребенка — это условный показатель. По факту игровая комната выполняет роль столовой, учебного помещения. Здесь стоят столы, стулья, игрушки, методическое оборудование. То есть половина зала занята мебелью. Таким образом, остается 50 процентов площади.
Практический результат
1. Ребенок получает возможность реализовать право на индивидуальное развитие
2. Создается комфортная эмоциональная среда, позволяющая сохранить психику ребенка.
2. Уменьшается скученность детей, снижается заболеваемость
3. Ребенок легче адаптируется к дошкольному учреждению, снижается заболеваемость детей раннего возраста.
4. В результате снижения заболеваемости экономятся средства ФОМС, которые можно направить на преодоление сложных заболеваний.
5. Ребенок, находясь в благоприятной психологической обстановке, лучше развивается коммуникативно, эмоционально.
7. Группа, в которой ребенок проводит до 12 часов ежедневно, может быть зонирована для организации разнообразной деятельности детей, в том числе индивидуальной.
8. Воспитателю возвращается изначальное назначение – растить и воспитывать здоровых, разносторонне развитых детей.
 Это может снизить отток педагогических кадров.
Это может снизить отток педагогических кадров.
Количество детей в группе детского сада по санпин 2019
26 июля 2018
Аверьянова Света
Наполняемость групп детского сада – острый вопрос. Все знают об оптимизации, уплотняемости, нехватке мест в дошкольных учреждениях для всех желающих. Создавая группу, записывая малышей, администрация сада обязана учитывать законодательные нормы по количеству детей в группе детского сада.
Из этой статьи вы узнаете
Нормы
В СССР комплектование групп проводилось по нормам, созданным постановлением Минтруда от 1993 года. В нем есть расчет количества персонала, оборудования. По советским законам в группе могло одновременно находиться не более 20 детей 3–7 лет. Сегодня нормы изменились.
1 октября 2010 года приняты новые СанПиН, по которым важным стал не списочный состав малышей, а фактический приход детей в сад. Нормы рассчитываются, исходя из площади игрового помещения.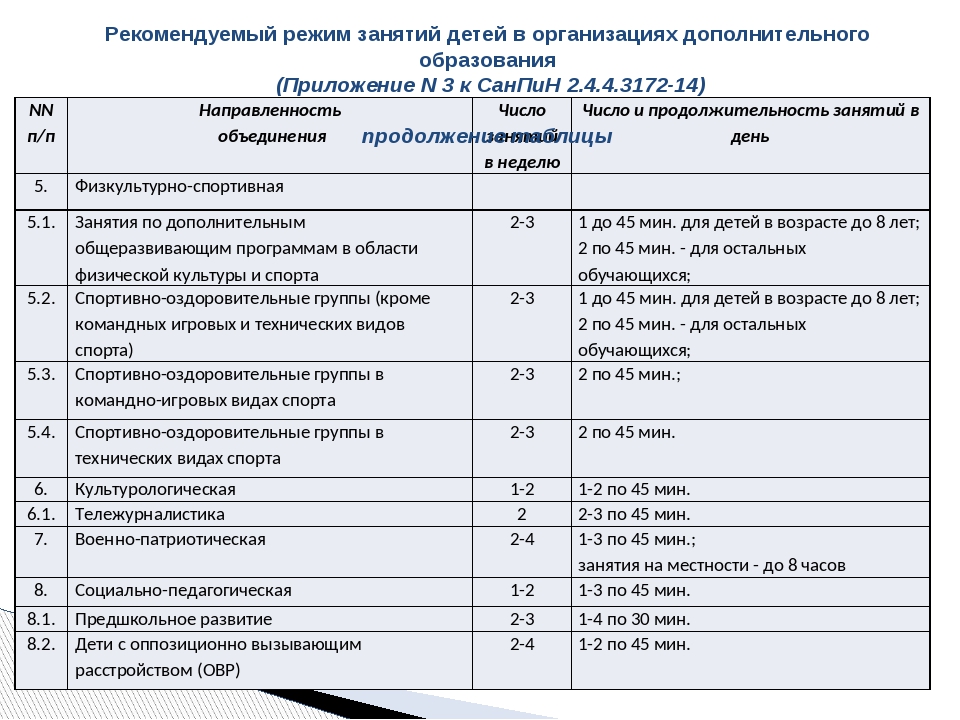 На каждого воспитанника должно приходиться не менее 2 квадратных метров для крох от 3 лет, не менее 2,5 квадратных метра — в младшей группе.
На каждого воспитанника должно приходиться не менее 2 квадратных метров для крох от 3 лет, не менее 2,5 квадратных метра — в младшей группе.
Расчет прост. Если площадь игровой комнаты составит 70 квадратных метров, то одновременно в ней могут находиться 28 ясельников или 35 воспитанников с 3 до 7 лет. При этом количество обслуживающего и педагогического персонала не увеличивается.
Учитывается только фактический список пребывания детей в садике в данный момент, по списку их может быть 45–49.
Еще одним новшеством в нормативном документе стало разрешение на переоборудование игрового помещения на время сонного часа в спальню. Детский сад приобретает раскладушки, воспитатели расставляют их в игровой комнате для тех, кому стационарных кроватей не хватает.
После сна оборудование убирается, игровая зона свободна.
Стоит учитывать, что 2 или 2,5 квадратных метра на ребенка — это условный показатель. По факту игровая комната выполняет роль столовой, учебного помещения. Здесь стоят столы, стулья, игрушки, методическое оборудование. То есть половина зала занята мебелью. Таким образом, остается 50 процентов площади.
Здесь стоят столы, стулья, игрушки, методическое оборудование. То есть половина зала занята мебелью. Таким образом, остается 50 процентов площади.
Детским садам с узконаправленной деятельностью повезло больше. Малышам с дефектами психического, речевого, умственного и физического развития предложили другие условия пребывания в ДОУ:
- С серьезными дефектами речи — до 10 воспитанников, с ФФНР — до 12.
- Глухонемых, глухих — допустимая численность 6 человек.
- Слабослышащих — до 8.
- Слепых — до 10.
- С ДЦП, нарушениями опорно-двигательного аппарата — не более 8.
- С умственной отсталостью, кретинизмом — до 10.
- В комбинированной группе с разноплановыми дефектами — набирать для образования можно не более 15 человек.
Такая ситуация не понравилась инициативным родителям дошколят, представителям Общественной палаты. Были поданы запросы на разъяснение законодательных актов, нормативных документов. Ответ пришел от Роспотребнадзора.
Разъяснения от Роспотребнадзора
В январе 2013 года на вопросы родителей о законности СанПиН 2.4.1.2660-10 ответили письмом. Роспотребнадзор объяснил, как нужно понимать увеличение группы в детском саду. Пункт 1.10 дает возможность администрации ДОУ формировать группу по списку максимум 50 человек. Если из записанных малышей утром пришли в садик 25 человек, площадь помещения позволяет вместить такое количество воспитанников, то закон не нарушается.
Остается один вопрос, если в один прекрасный солнечный день, все «списочные» решат посетить любимых воспитателей и придут в детсад полным составом, где им ложиться спать, кушать и играть?
Для нормирования пребывания возможно использование запасной группы в детском саду, то есть свободного, но оборудованного для такой ситуации помещения. В этом случае у ДОУ должны быть и «запасные» воспитатели, няни, игрушки, посуда и т.д.
Таким образом, СанПиН, установленные в 2010 году, действуют и в 2019-м. Изменений на данный момент нет. Наполнение, оборудование помещений ведется с учетом законодательных актов. Их соблюдение проверяется ежегодно министерствами, внеплановым контролем.
Наполнение, оборудование помещений ведется с учетом законодательных актов. Их соблюдение проверяется ежегодно министерствами, внеплановым контролем.
От 30 до 40 51%, 3115 голосов
3115 голосов 51%
3115 голосов – 51% из всех голосов
До 30 30%, 1824 голоса
1824 голоса 30%
1824 голоса – 30% из всех голосов
Свыше 40 20%, 1202 голоса
1202 голоса 20%
1202 голоса – 20% из всех голосов
Всего голосов: 6141
26.07.2018
×
Вы или с вашего IP уже голосовали.Как проконтролировать соблюдение СанПиН
К сожалению, сегодняшняя действительность, тотальная халатность работников детских учреждений в вопросе присмотра за воспитанниками, их безопасности, обеспечения нормальными условиями пребывания в ДОУ не дает родителям возможности расслабиться и быть спокойными за детишек.
Контроль соблюдения прав дошколят — обязанность взрослых. Не нужно терпеть, пускать все на самотек. При возникновении вопросов, недовольства работой садика, воспитателей, нарушениях закона можно обратиться в государственные службы с заявлениями:
Администрация ДОУ
Решает вопросы внутреннего порядка. Если проблема серьезная, то лучше использовать письменную форму обращения, добиваясь ответа в той же форме. Это необходимо для дальнейшего заявления в вышестоящую инстанцию при бездействии заведующей ДОУ.
Управление образования муниципального, областного, федерального значения
Орган регулирует учебный план ДОУ, режим работы и отдыха воспитанников детского сада. К начальнику образовательного отдела можно прийти на личную встречу, написать письмо через официальный сайт.
Комплектование групп, отслеживание процента посещаемости относится к сфере деятельности управления. Именно по их срезам, диагностике и разрешается объединение нескольких групп в одну при низком проценте посещающих садик детей.
При обращении к начальнику управления образования в устной форме не забудьте составить письмо, требуйте его регистрации, ответа в электронной форме или письменно.
Роспотребнадзор
Письмо отправляется через сайт госуслуг, через официальную страницу службы. В заявлении обязательно укажите точные данные о проблеме, свои контакты. По жалобе разбирательство начнется не позднее 30 дней со дня подачи.
Специалисты Роспотребнадзора помогают устранить недочеты по содержанию детей, соблюдению гигиенических норм. К ним можно обратиться, если детям в многокомплектной группе не хватает кроватей, стульев, унитазов, шкафчиков для одежды, постельного белья. При несоблюдении СанПиН по площади помещения для группы в расчете на каждого ребенка заявление подается тут же.
На основе жалобы проводится выездная комиссия обычно совместно с прокуратурой. Заявление лучше составлять по факту нарушения прав детей, точно указывая дату, подробности произошедшего.
Прокуратура РФ
Принимает жалобы от населения через интернет, в письменной форме, лично.
В основу заявления должен лечь факт нарушения норм, законов. Лучшим вариантом обращения будет коллективное заявления от большого числа родителей с подписями и расшифровками.
Полномочные представители президента по округам
Если администрация ДОУ, города, контролирующие органы местной власти бездействуют, не отвечают на ваши запросы, обращайтесь с письменными заявлениями на официальные сайты полпредов. Опишите ситуацию подробно, приложите ответы других структур на запросы по проблеме, ваши жалобы.
Представители партий
На местном уровне помогают администрации прийти в чувство, обратить внимание на соблюдение норм и правил организации образовательного процесса. Подключайте к проблемам в ДОУ представителей политических партий, если хотите создать общественное волнение, привлечь к жалобе внимание прессы.
На войне все средства хороши. Если права ваших детей нарушены, пользуйтесь любыми средствами для того, чтобы их отстоять. Не бойтесь осуждения, проблем на работе, третирования ребенка в детском саду. Здоровье, безопасность малышей важнее. А активность родителей в защите ребенка вызывает уважение и трепет у воспитателей, поэтому дошкольнику ничего не угрожает, скорее, наоборот, к нему будут относиться внимательнее.
Здоровье, безопасность малышей важнее. А активность родителей в защите ребенка вызывает уважение и трепет у воспитателей, поэтому дошкольнику ничего не угрожает, скорее, наоборот, к нему будут относиться внимательнее.
Как добиться разделения группы
Иногда администрация ДОУ слишком увлекается оптимизацией, стремится перевыполнить план экономии средств, данный свыше. Комплектование групп в этом случае ведется с нарушением законов и принятых норм. Родители могут подавать жалобы на действия управления образования, заведующих детских садов в следующих ситуациях:
- Дети посещают детский сад постоянно в максимальном количестве.
То есть площадь помещения рассчитана на 28 человек, по списку малышей 40, ходят в ДОУ все. Нарушаются СанПиН. Для подачи заявления необходим подтвержденный факт наличия детей в группе в определенный период времени, заявления для разъяснения вопроса на имя заведующей, опрос воспитателей. Жалоба подается в прокуратуру, Роспотребнадзор.
- Нехватка спальных мест для всех присутствующих, обеденной мебели, посуды.
Например, кроватей и раскладушек 29, а детей в группу пришло 34. Вопрос: где спят и раздеваются 5 воспитанников ДОУ?
- Сон ребенка на чужой кровати без смены белья.
Не секрет, что раскладушку применяют только в том случае, если все кроватки заняты. В том случае, если Петя Иванов сегодня не пришел, то Машу укладывают на его кроватку, постелив чистое белье. Это не является нарушением закона. Чистый комплект из простыни и наволочки хранится в специальном ящике, подписанный датой упаковки после санитарной обработки. Если белье не сменили, гигиена нарушается регулярно, подавайте жалобу в Роспотребнадзор.
- Численность одной группы составила 50 детей.
В этом случае коллектив делится по закону. Образуются две группы одного возраста. Учтите, что комплектование ведется круглый год. Разделение производится сразу после добора.
Винить воспитателей в сложившейся обстановке не стоит.
Наемные работники выполняют указания администрации. Относитесь к их работе в многокомплектной группе с пониманием. Уследить за таким количеством малышей крайне сложно.
Писать жалобы, заявления в прокуратуры за малейшую царапину, синячок не стоит. Но обратиться к заведующей, в органы надзора в случае систематических беспорядков, если воспитатель не справляется с нагрузкой, нужно обязательно.
Чем грозит несоблюдение норм
Формирование многочисленной группы в детском саду — большой риск. Нахождение в толпе, в тесном помещении, дефицит внимания пагубно сказываются на психическом и физическом состоянии детей. Малыши чаще болеют, отказываются идти в садик, плачут, нервничают, страдает память, внимание, сон.
Группа детского сада – это небольшое государство. Со своими интересами, целями, задачами и особенностями. А живут в нем наши дети, так сказать, граждане маленькой страны. Для гармоничного пребывания друг с другом 5 дней в неделю, не менее 8 часов каждые сутки, важно создавать оптимальные для этого условия. Одним из показателей правильной работы администрации сада является комплектование групп.
Одним из показателей правильной работы администрации сада является комплектование групп.
От того, сколько детей будет в группе детского сада, зависит:
- Эффективность образования
Даже в ясельных группах ведутся занятия по рисованию, лепке, развитию речи. Образовательные программы прописываются согласно возрасту и уровню здоровья дошкольников. Обучение ведется вплоть до выпуска детей в школы.
Проводить занятия с небольшим количеством детей в саду легче и эффективнее, чем в массово переполненной группе.
- Психическое состояние
Детский организм, психика – тонкая материя. Постоянное нахождение в толпе, одиночество, отсутствие заботы и внимания от педагога пагубно влияют на развитие личности. При расчете норм по количеству воспитанников ДОУ этот факт учитывается.
- Уровень здоровья
Медицинские исследования последних десятилетий указывают на понижение уровня здоровья новорожденных. Являются абсолютно здоровыми только 5–7 процентов первоклассников, 40 процентов малышей уже рождаются с патологиями, остальные заболевают в дошкольный период.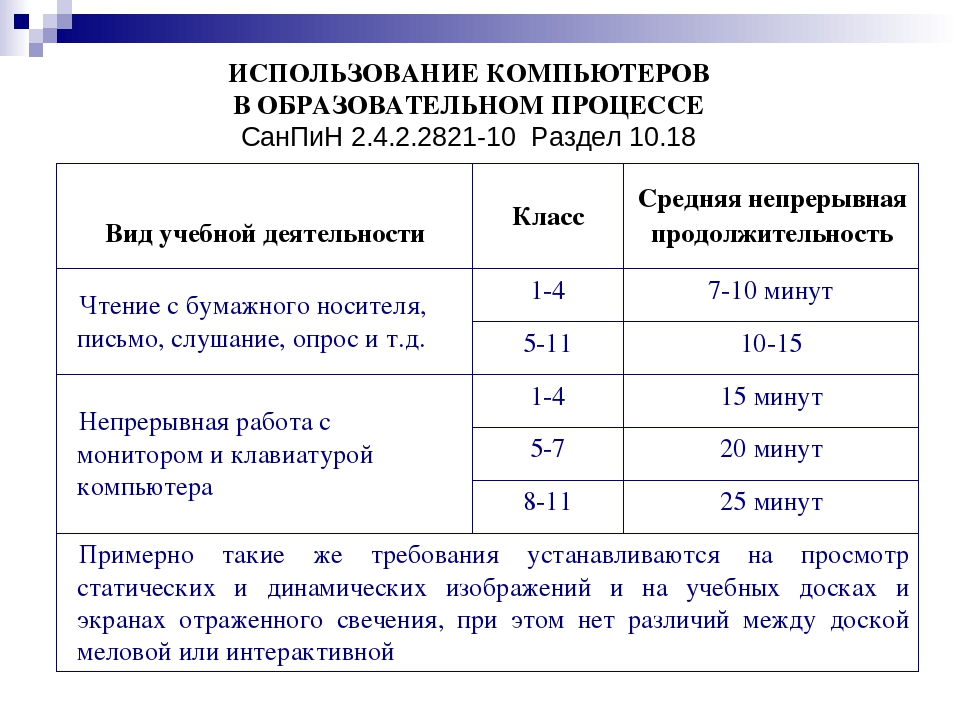 Деятельность дошкольных образовательных учреждений направлена на улучшение показателей медицинских исследований.
Деятельность дошкольных образовательных учреждений направлена на улучшение показателей медицинских исследований.
- Обеспеченность свободной площадью в помещении для игр, движения
Чем больше детей в группе, тем масштабнее площадь. Каждый имеет право на свободное пространство для активных игр, общения с ровесниками, индивидуальных занятий.
- Безопасность
Представьте себе, что вам нужно одновременно держать в поле зрения 20 человек или 50. Какой вариант кажется реальнее? Скорее, первый. От возможности наблюдать, следить за всеми на прогулке, в процессе занятий зависит безопасность малышей в ДОУ (дошкольное образовательное учреждение).
Родителям важно «отвоевать» положенные по закону метры в помещении, личный стул, шкафчик для одежды, кровать. Нельзя допускать переполненности группы, размещения вещей нескольких детей в один шкаф для верхней одежды. Это грозит педикулезом, эпидемиями, распространением инфекций.
Как помочь ребенку адаптироваться
Чаще родителям и детям приходится смириться с уплотнением, если соблюдаются СанПиН, группа обеспечена всем необходимым. В этом случае нужно помочь дошкольнику адаптироваться в садике с большим количеством ровесников.
В этом случае нужно помочь дошкольнику адаптироваться в садике с большим количеством ровесников.
Для малышей 2–3 лет находиться 8–10 часов в окружении еще 35–40 человек такого же возраста сложно психологически.
Шум, гам, толкотня, игры утомляют, вводят в состояние стресса. Родители могут оказать ребенку посильную помощь, чтобы развитие нервной и других систем не пришло в дисгармонию:
- Принесите из дома подушку, постельное белье. Ребенок почувствует себя как дома в период сонного часа.
- Разрешите взять в садик любимую игрушку.
- Устраивайте внеплановые выходные. Оставляйте малыша с бабушкой или родственниками.
- Наладьте с воспитателями доверительные отношения. Подружитесь с ними, подробно расспрашивайте о ребенке вечером. Внимательные родители (без фобий и агрессии) — залог безопасности ребенка в детском саду.
- После садика проводите с ребенком больше времени в тишине, без телевизора, мультиков, шумных компаний. Малышу нужно отдохнуть от психологической нагрузки за день.
 Лучше погуляйте в парке, поиграйте в мяч, догонялки.
Лучше погуляйте в парке, поиграйте в мяч, догонялки. - Соблюдайте режим сна. Невыспавшийся дошкольник устанет гораздо быстрее, будет раздражительным и нервным.
- Забирайте ребенка пораньше, в выходные и отпуск не водите в детский сад.
Отвечать на вопрос, сколько детей должно быть в группе детского сада предельно, можно по-разному. Для комфортного пребывания, с точки зрения психологов, детей — не больше 20, лучше 15. По мнению экономистов, оптимизаторов, больше 40. Несовпадение мнений ведет к спорам, недовольству, хотя вопрос можно решать иначе:
- разрешение комплектовать частные группы в здании муниципальных детских садов;
- поддержка бизнеса по созданию сетей дошкольных учреждений с дневным пребыванием;
- внимательное отношение к детям, их здоровью и развитию по-настоящему, а не ради отчета в министерства.
Только комплекс мер поможет в преодолении дефицита мест в ДОУ или при их избытке.
ВАЖНО! *при копировании материалов статьи обязательно указывайте активную ссылку на первоисточник: https://razvitie-vospitanie. ru/otveti/kolichestvo_detej_v_gruppe_detskogo_sada.html
ru/otveti/kolichestvo_detej_v_gruppe_detskogo_sada.html
Если вам понравилась статья — поставьте лайк и оставьте свой комментарий ниже. Нам важно ваше мнение!
Поделиться с друзьями:
Сколько детей в детском саду в среднем?
Дефицит мест в детских садах сегодня является одной из самых острых проблем России. Однако кое-какие шаги для покрытия дефицита правительство России уже предприняло. Речь идет об изменениях в СанПиН (санитарных нормах и правилах для детских дошкольных учреждений), согласно которым группы в детских садах можно вполне официально «уплотнить».
До 1 октября 2010 года Типовым положением о ДОУ (дошкольные образовательные учреждения), Постановлением Минтруда РФ от 21.04.1993 № 88 «Об утверждении Нормативов по определению численности персонала, занятого обслуживанием дошкольных учреждений (ясли, ясли-сады, детские сады)» и СанПиН для ДОУ были установлены достаточно жесткие условия работы детских садов.
Напомним, согласно санитарным правилам СанПиН 2.4.1.1249-03 количество детей в группах определялось исходя из их предельной наполняемости. А именно:
до 1 года — не больше 10 детей;
до 3 лет — не больше 15 детей;
3-7 лет — не больше 20 детей (оптимально 15 детей).
Согласно новым санитарным правилам норму количества детей в группе стали рассчитывать исходя из общей игровой площади (включая площадь, занятую мебелью) помещения:
для ясельных групп — не меньше 2,5 кв.м. на одного ребенка;
для дошкольных групп — не меньше 2 кв.
 м. на одного ребенка.
м. на одного ребенка.Нормы рассчитываются, исходя из площади игрового помещения. Расчет прост. Если площадь игровой комнаты составит 70 квадратных метров, то одновременно в ней могут находиться 28 ясельников или 35 воспитанников с 3 до 7 лет. При этом количество обслуживающего и педагогического персонала не увеличивается. Учитывается только фактический список пребывания детей в садике в данный момент, по списку их может быть 45–49. Еще одним новшеством в нормативном документе стало разрешение на переоборудование игрового помещения на время сонного часа в спальню. Детский сад приобретает раскладушки, воспитатели расставляют их в игровой комнате для тех, кому стационарных кроватей не хватает. После сна оборудование убирается, игровая зона свободна. Стоит учитывать, что 2 или 2,5 квадратных метра на ребенка — это условный показатель. По факту игровая комната выполняет роль столовой, учебного помещения. Здесь стоят столы, стулья, игрушки, методическое оборудование. То есть половина зала занята мебелью.

Новый СанПиН превращает дошкольное учреждение из детского сада, где ребята имели возможность разносторонне развиваться под руководством педагога в «площадку молодняка», где воспитатель, в лучшем случае, может наблюдать за тем, чтобы дети по возможности были целы.
«Создание условий – основа для воспитания». Л. С. Выготский. Конечно, каждый из родителей, так или иначе, имеет собственный взгляд и мнение о том, как правильно воспитывать свое чадо, чем кормить и когда укладывать спать в кроватку. Чаще всего такие знания черпаются из советов родителей, бабушек и других молодых мамочек, хорошим подспорьем является современная литература. Несмотря на это, никто не застрахован от ошибок, которые особенно часто допускаются при рождении и воспитании первого ребенка, в связи с недостатком опыта.
Однако никто не отменяет основные принципы здорового образа жизни малыша, к примеру, нельзя допускать перегрев на солнце, пытаться, заталкивать в любимое чадо еще одну котлету, если он не голоден. Желательно, чтобы ребенок был подвижным, активным, общался со сверстниками, достаточное время находился на улице и дышал свежим воздухом.
Желательно, чтобы ребенок был подвижным, активным, общался со сверстниками, достаточное время находился на улице и дышал свежим воздухом.
Отдавая малыша в детсад, необходимо обсудить с воспитателем рацион питания, если есть аллергия на пищевые продукты – обязательно оповестите об этом работника дошкольного учреждения. Температура воздуха в группе, уровень влажности, частота проветриваний помещения – ничего не должно оставить вас равнодушным.
Для этого и существует СанПин, в котором четко прописаны нормы правильного содержания ребенка в детском саду. В 2015 году принята новая редакция СанПина, устанавливающая необходимые условия, согласно освещению, микроклимату детсадовских групп. Специалисты советуют молодым родителям хотя бы краешком глаза ознакомиться с рекомендациями в документе, где можно открыть для себя много нового.
Важность показателя наполняемости групп в детских садах
Сколько человек может быть в группе детского сада? Почему именно этот вопрос должен вас заинтересовать в первую очередь? Наши дети – это наше все, наше будущее, и от того, что будет заложено в детстве, зависит успех на перспективу.
Читайте также: Как записать в детский сад ребенка
Российский опыт показал, что образовательная среда также влияет на малышей, ведь здесь они проводят как минимум половину своего детства. Все здесь должно быть в гармоничных отношениях с детским организмом и создано исключительно для детей.
Принимать соответствующие меры по оздоровлению заставляют и последние медицинские исследования, утверждающие, что среди малышей школьного возраста и подростков только 5-7% не имеют отклонений в физическом плане, т. е. совершенно здоровы. За последние 5-6 лет каждый год рождается около 40% детей, не отличающихся здоровьем, некоторые из них заболевают в первые недели после появления на свет. Около 10% человек рождаются с недостаточным весом и затем на протяжении несколько лет борются с лишними килограммами.
Поэтому целью дошкольных учреждений для детей в первую очередь является создание благоприятных условий и среды в целом для настоящего и будущего развития детского организма во время пребывания в группе детского сада.
Тотальная нехватка мест в детских садах
Как бы ни следили контролирующие органы за численностью детей, находящихся в детсадах, но факт остается фактом – по закону состав детей в группе любого государственного или частного детского сада, в расчете на занимаемую площадь, не может превышать 20 человек в возрасте до 3-х лет, и выше – 25 человек.
Однако в реальности наполняемость превышает эти нормы практически на 41%, особо острая ситуация складывается в российских муниципальных учреждениях, состоящих на балансе у государства. При этом здания и сооружения, входящие в территорию дошкольных учреждений, рассчитаны совсем на другую численность малышей.
Новые детские сады не спешат строить, при этом рождаются новые и новые дети, с потоком которых давно построенные учреждения уже не справляются. Для того чтобы малыш попал в сад, сегодня необходимо записываться и становиться в очередь чуть ли не с момента его рождения.
Специалисты подчеркивают, что массовое переуплотнение детей в группе детского сада не может пройти бесследно. Так, с каждым годом наблюдается:
- Снижение качества образовательных процессов и развития малышей в группе.
- Увеличивается показатель риска заболеваемости в целом.
- Дети быстрее устают.
- Увеличение показателя травматизма.
- Уменьшение активности детей.
Таким образом, дети и родители уже сейчас сталкиваются с тем, что на их нужды просто «забивают», процесс хождения в государственный детский сад превращается в мучение, поэтому часто родители вынуждены переводить свое чадо в коммерческие структуры, которое также не всегда обеспечивают должный уровень комфорта.
Как проконтролировать соблюдение правил СанПина 2017-2018 года
Не нужно думать, что бороться с бесправием в дошкольных учреждениях бесполезно. Часто работники проявляют халатность даже там, где, казалось бы, нарушить уже в принципе и нечего.
Российское правительство подписало Конвенцию о правах малышей, в которой четко прописаны права на игровые занятия, на обеспечение здоровья и полноценного рациона питания несовершеннолетнего. Конечно, малыш не может в силу возрастных особенностей отстоять то, что ему положено, но это могут сделать взрослые, его родители. Поэтому если у вас возникают претензии к воспитателям или руководству – озвучивайте их, жалуйтесь, призывайте к исправлению ошибок.
Читайте также: Как участвовать в очереди в хороший детский сад
Тем более что вы платите налоги, а значит, следующие инстанции, куда можно подать жалобу, работают именно для вас:
- Комитет образования областного и федерального значения. Устанавливает часы работы и отдыха детей, а также утверждает планы по учебе для воспитателей;
- Роспотребнадзор. Главная контролирующая служба, проверяющая состояние содержания детей в группе детского сада, а именно уровень чистоты, качество игрушек, наличие сертификации на моющие и средства личной гигиены;
- прокуратора. Появляется только по надобности, если уже произошел какой-либо инцидент;
- пожарный надзор.
Некоторые мамочки указывают, что замечания лишь приведут к дополнительным проблемам, которые отразятся на ребенке. Но задумывались ли они, что может быть страшнее, чем потеря его здоровья? Насколько оправдана такая лояльность?
Внимание! Для посетителей нашего сайта действует акция: получите бесплатную консультацию юриста, просто оставив свой вопрос в форме ниже и в течение 5 минут вы получите на него ответ.
В Первомайском районе тоже беда с количеством детей в группах:
«В нашем саду в средней группе 35 человек, немало, конечно. Но сад с меньшим количеством детей находится почти в Зеленом луге, возить туда ребенка – это целое наказание, т.к. нужно ехать на транспорте с пересадкой».
«Мы ходим в сад в военном городке в Уручье, группы в нем достаточно большие – 30 детей. Но выбора у нас нет».
В других районах города, по словам мам, группы не настолько переполнены. Но спорные ситуации тоже возникают.
Читайте также: Что делать, если ребенок отказывается идти в сад?
«Мы хотели попасть в садик не в сентябре, как это принято, а в марте. Пошли в тот сад, куда стоим на очереди, нам сказали, что мест у них нет. Мол, извините, приходите в сентябре, а то даже кроватку для сна некуда поставить, в списке уже 23 ребенка. Через неделю я узнала, что в эту группу все-таки взяли ребенка, и место нашлось, и кроватка» (Заводской район Минска).
«В Лошице проблематично устроиться в сад и школу, например, в старшей группе у сына 34 ребенка. Как за ними всеми можно должным образом усмотреть?! Я знаю, что некоторые родители возят детей в сады в Серебрянку, где нет такого ажиотажа, как у нас» (Ленинский район Минска).
«В старшей группе у дочки по списку 23 человека. Это очень даже неплохо по сравнению с количеством детей в садах на Каменной горке, как у моей подруги» (Московский район Минска).
«Мы ходим в сад в районе Тракторного завода, на переполненные группы не жалуемся. У нас в группе по списку 21 человек, а ходит и то меньше, особенно, зимой» (Партизанский район Минска)
Источник фото: .com
«Мы живем около Больницы скорой помощи, в саду у нас 26 человек, немного, если сравнивать с другими районами» (Октябрьский район Минска).
«Мы живем возле м. Фрунзенская, в саду у нас в средней группе 24 человека, в младшей группе было меньше» (Центральный район Минска).
Читайте также: Когда деньги не будут выброшены на ветер. 10 самых полезных развивающих игрушек
Что по нормам?
Наполняемость групп детских садов регулируется санитарными нормами, правилами и гигиеническими нормативами «Гигиенические требования к устройству, содержанию и режиму деятельности учреждений дошкольного образования», утвержденными постановлением Министерства здравоохранения РБ № 42 от 17.04.2009.
В них указано, что в первой младшей группе должно быть не более 15 детей, во второй младшей, средней и старшей – не более 20. Увы, такие цифры редко встречаются в реальности.
Комментарий специалиста: «Санитарные службы идут навстречу»
Елена Макаревич, главный специалист отдела дошкольного, общего среднего и специального образования Комитета по образованию Мингорсполкома:
— В настоящее время в Минске, к сожалению, не во всех садах выполняются данные нормы. На это есть ряд объективных причин: и увеличение количества детей, и недостаточное количество мест в учреждениях, расположенных в микрорайонах-новостройках.
Выдачу направлений в учреждения дошкольного образования, то есть комплектование детских садов осуществляют управления образования администраций районов г. Минска. В каждом районе ведется учет детей, родители которых желают определить ребенка в тот или иной сад.
В феврале-марте в управлениях по образованию начинается работа по предварительному комплектованию садов на новый учебный год: анализируется количество детей по возрасту и желаемому учреждению образования, а также количество мест в том или ином саду.
Исходя из полученных результатов, управлением по образованию с учетом возможностей каждого дошкольного учреждения принимается решение о наполняемости групп. Если дошкольное учреждение способно обеспечить спальными местами и всем необходимым детей сверх нормативного количества, то санитарные службы идут навстречу, разрешая увеличить количество детей в группах детского сада сверх положенного.
Источник фото: .com
Хочется отметить, что проблема обеспеченности местами в садах в настоящее время существует в микрорайонах с активным строительством жилья, это, в первую очередь, Московский, Первомайский и Фрунзенский районы.
С целью ее решения и во исполнение поручения Главы государства по обеспечению учреждениями образования шаговой доступности разработан план строительства в Минске 20 дополнительных учреждений дошкольного образования.
Управлениями по образованию и самими дошкольными учреждениями принимаются максимально возможные меры по созданию условий для получения воспитанниками качественного образования. Это и организация занятий с воспитанниками по подгруппам, и дополнительное обеспечение мебелью, оборудованием, мягким инвентарем и др. В одночасье урегулировать вопрос переукомплектованности групп, к сожалению, невозможно. Хочется, чтобы родители с пониманием относились к сложившейся ситуации.
Разъяснения от Роспотребнадзора
В январе 2013 года на вопросы родителей о законности СанПиН 2.4.1.2660-10 ответили письмом. Роспотребнадзор объяснил, как нужно понимать увеличение группы в детском саду. Пункт 1.10 дает возможность администрации ДОУ формировать группу по списку максимум 50 человек. Если из записанных малышей утром пришли в садик 25 человек, площадь помещения позволяет вместить такое количество воспитанников, то закон не нарушается.
Остается один вопрос, если в один прекрасный солнечный день, все «списочные» решат посетить любимых воспитателей и придут в детсад полным составом, где им ложиться спать, кушать и играть?
Для нормирования пребывания возможно использование запасной группы в детском саду, то есть свободного, но оборудованного для такой ситуации помещения. В этом случае у ДОУ должны быть и «запасные» воспитатели, няни, игрушки, посуда и т.д.
Таким образом, СанПиН, установленные в 2010 году, действуют и в 2019-м. Изменений на данный момент нет. Наполнение, оборудование помещений ведется с учетом законодательных актов. Их соблюдение проверяется ежегодно министерствами, внеплановым контролем.
Сколько детей в группе вашего ребенка?
Как проконтролировать соблюдение СанПиН
К сожалению, сегодняшняя действительность, тотальная халатность работников детских учреждений в вопросе присмотра за воспитанниками, их безопасности, обеспечения нормальными условиями пребывания в ДОУ не дает родителям возможности расслабиться и быть спокойными за детишек.
Контроль соблюдения прав дошколят — обязанность взрослых. Не нужно терпеть, пускать все на самотек. При возникновении вопросов, недовольства работой садика, воспитателей, нарушениях закона можно обратиться в государственные службы с заявлениями:
Администрация ДОУ
Решает вопросы внутреннего порядка. Если проблема серьезная, то лучше использовать письменную форму обращения, добиваясь ответа в той же форме. Это необходимо для дальнейшего заявления в вышестоящую инстанцию при бездействии заведующей ДОУ.
Управление образования муниципального, областного, федерального значения
Орган регулирует учебный план ДОУ, режим работы и отдыха воспитанников детского сада. К начальнику образовательного отдела можно прийти на личную встречу, написать письмо через официальный сайт.
Комплектование групп, отслеживание процента посещаемости относится к сфере деятельности управления. Именно по их срезам, диагностике и разрешается объединение нескольких групп в одну при низком проценте посещающих садик детей.
При обращении к начальнику управления образования в устной форме не забудьте составить письмо, требуйте его регистрации, ответа в электронной форме или письменно.
Роспотребнадзор
Письмо отправляется через сайт госуслуг, через официальную страницу службы. В заявлении обязательно укажите точные данные о проблеме, свои контакты. По жалобе разбирательство начнется не позднее 30 дней со дня подачи.
Специалисты Роспотребнадзора помогают устранить недочеты по содержанию детей, соблюдению гигиенических норм. К ним можно обратиться, если детям в многокомплектной группе не хватает кроватей, стульев, унитазов, шкафчиков для одежды, постельного белья. При несоблюдении СанПиН по площади помещения для группы в расчете на каждого ребенка заявление подается тут же.
На основе жалобы проводится выездная комиссия обычно совместно с прокуратурой. Заявление лучше составлять по факту нарушения прав детей, точно указывая дату, подробности произошедшего.
Прокуратура РФ
Принимает жалобы от населения через интернет, в письменной форме, лично.
В основу заявления должен лечь факт нарушения норм, законов. Лучшим вариантом обращения будет коллективное заявления от большого числа родителей с подписями и расшифровками.
Полномочные представители президента по округам
Если администрация ДОУ, города, контролирующие органы местной власти бездействуют, не отвечают на ваши запросы, обращайтесь с письменными заявлениями на официальные сайты полпредов. Опишите ситуацию подробно, приложите ответы других структур на запросы по проблеме, ваши жалобы.
Представители партий
На местном уровне помогают администрации прийти в чувство, обратить внимание на соблюдение норм и правил организации образовательного процесса. Подключайте к проблемам в ДОУ представителей политических партий, если хотите создать общественное волнение, привлечь к жалобе внимание прессы.
На войне все средства хороши. Если права ваших детей нарушены, пользуйтесь любыми средствами для того, чтобы их отстоять. Не бойтесь осуждения, проблем на работе, третирования ребенка в детском саду. Здоровье, безопасность малышей важнее. А активность родителей в защите ребенка вызывает уважение и трепет у воспитателей, поэтому дошкольнику ничего не угрожает, скорее, наоборот, к нему будут относиться внимательнее.
Как добиться разделения группы
Иногда администрация ДОУ слишком увлекается оптимизацией, стремится перевыполнить план экономии средств, данный свыше. Комплектование групп в этом случае ведется с нарушением законов и принятых норм. Родители могут подавать жалобы на действия управления образования, заведующих детских садов в следующих ситуациях:
- Дети посещают детский сад постоянно в максимальном количестве.
То есть площадь помещения рассчитана на 28 человек, по списку малышей 40, ходят в ДОУ все. Нарушаются СанПиН. Для подачи заявления необходим подтвержденный факт наличия детей в группе в определенный период времени, заявления для разъяснения вопроса на имя заведующей, опрос воспитателей. Жалоба подается в прокуратуру, Роспотребнадзор.
- Нехватка спальных мест для всех присутствующих, обеденной мебели, посуды.
Например, кроватей и раскладушек 29, а детей в группу пришло 34. Вопрос: где спят и раздеваются 5 воспитанников ДОУ?
- Сон ребенка на чужой кровати без смены белья.
Не секрет, что раскладушку применяют только в том случае, если все кроватки заняты. В том случае, если Петя Иванов сегодня не пришел, то Машу укладывают на его кроватку, постелив чистое белье. Это не является нарушением закона. Чистый комплект из простыни и наволочки хранится в специальном ящике, подписанный датой упаковки после санитарной обработки. Если белье не сменили, гигиена нарушается регулярно, подавайте жалобу в Роспотребнадзор.
- Численность одной группы составила 50 детей.
В этом случае коллектив делится по закону. Образуются две группы одного возраста. Учтите, что комплектование ведется круглый год. Разделение производится сразу после добора.
Винить воспитателей в сложившейся обстановке не стоит.
Наемные работники выполняют указания администрации. Относитесь к их работе в многокомплектной группе с пониманием. Уследить за таким количеством малышей крайне сложно.
Писать жалобы, заявления в прокуратуры за малейшую царапину, синячок не стоит. Но обратиться к заведующей, в органы надзора в случае систематических беспорядков, если воспитатель не справляется с нагрузкой, нужно обязательно.
Чем грозит несоблюдение норм
Формирование многочисленной группы в детском саду — большой риск. Нахождение в толпе, в тесном помещении, дефицит внимания пагубно сказываются на психическом и физическом состоянии детей. Малыши чаще болеют, отказываются идти в садик, плачут, нервничают, страдает память, внимание, сон.
Группа детского сада – это небольшое государство. Со своими интересами, целями, задачами и особенностями. А живут в нем наши дети, так сказать, граждане маленькой страны. Для гармоничного пребывания друг с другом 5 дней в неделю, не менее 8 часов каждые сутки, важно создавать оптимальные для этого условия. Одним из показателей правильной работы администрации сада является комплектование групп.
От того, сколько детей будет в группе детского сада, зависит:
- Эффективность образования
Даже в ясельных группах ведутся занятия по рисованию, лепке, развитию речи. Образовательные программы прописываются согласно возрасту и уровню здоровья дошкольников. Обучение ведется вплоть до выпуска детей в школы.
Проводить занятия с небольшим количеством детей в саду легче и эффективнее, чем в массово переполненной группе.
- Психическое состояние
Детский организм, психика – тонкая материя. Постоянное нахождение в толпе, одиночество, отсутствие заботы и внимания от педагога пагубно влияют на развитие личности. При расчете норм по количеству воспитанников ДОУ этот факт учитывается.
- Уровень здоровья
Медицинские исследования последних десятилетий указывают на понижение уровня здоровья новорожденных. Являются абсолютно здоровыми только 5–7 процентов первоклассников, 40 процентов малышей уже рождаются с патологиями, остальные заболевают в дошкольный период. Деятельность дошкольных образовательных учреждений направлена на улучшение показателей медицинских исследований.
- Обеспеченность свободной площадью в помещении для игр, движения
Чем больше детей в группе, тем масштабнее площадь. Каждый имеет право на свободное пространство для активных игр, общения с ровесниками, индивидуальных занятий.
- Безопасность
Представьте себе, что вам нужно одновременно держать в поле зрения 20 человек или 50. Какой вариант кажется реальнее? Скорее, первый. От возможности наблюдать, следить за всеми на прогулке, в процессе занятий зависит безопасность малышей в ДОУ (дошкольное образовательное учреждение).
Родителям важно «отвоевать» положенные по закону метры в помещении, личный стул, шкафчик для одежды, кровать. Нельзя допускать переполненности группы, размещения вещей нескольких детей в один шкаф для верхней одежды. Это грозит педикулезом, эпидемиями, распространением инфекций.
Как помочь ребенку адаптироваться
Чаще родителям и детям приходится смириться с уплотнением, если соблюдаются СанПиН, группа обеспечена всем необходимым. В этом случае нужно помочь дошкольнику адаптироваться в садике с большим количеством ровесников.
Для малышей 2–3 лет находиться 8–10 часов в окружении еще 35–40 человек такого же возраста сложно психологически.
Шум, гам, толкотня, игры утомляют, вводят в состояние стресса. Родители могут оказать ребенку посильную помощь, чтобы развитие нервной и других систем не пришло в дисгармонию:
- Принесите из дома подушку, постельное белье. Ребенок почувствует себя как дома в период сонного часа.
- Разрешите взять в садик любимую игрушку.
- Устраивайте внеплановые выходные. Оставляйте малыша с бабушкой или родственниками.
- Наладьте с воспитателями доверительные отношения. Подружитесь с ними, подробно расспрашивайте о ребенке вечером. Внимательные родители (без фобий и агрессии) — залог безопасности ребенка в детском саду.
- После садика проводите с ребенком больше времени в тишине, без телевизора, мультиков, шумных компаний. Малышу нужно отдохнуть от психологической нагрузки за день. Лучше погуляйте в парке, поиграйте в мяч, догонялки.
- Соблюдайте режим сна. Невыспавшийся дошкольник устанет гораздо быстрее, будет раздражительным и нервным.
- Забирайте ребенка пораньше, в выходные и отпуск не водите в детский сад.
Отвечать на вопрос, сколько детей должно быть в группе детского сада предельно, можно по-разному. Для комфортного пребывания, с точки зрения психологов, детей — не больше 20, лучше 15. По мнению экономистов, оптимизаторов, больше 40. Несовпадение мнений ведет к спорам, недовольству, хотя вопрос можно решать иначе:
- разрешение комплектовать частные группы в здании муниципальных детских садов;
- поддержка бизнеса по созданию сетей дошкольных учреждений с дневным пребыванием;
- внимательное отношение к детям, их здоровью и развитию по-настоящему, а не ради отчета в министерства.
Только комплекс мер поможет в преодолении дефицита мест в ДОУ или при их избытке.
Наполняемость групп в дошкольных учреждениях
]]>Подборка наиболее важных документов по запросу Наполняемость групп в дошкольных учреждениях (нормативно–правовые акты, формы, статьи, консультации экспертов и многое другое).
Судебная практика: Наполняемость групп в дошкольных учреждениях Открыть документ в вашей системе КонсультантПлюс:Подборка судебных решений за 2018 год: Статья 67 “Организация приема на обучение по основным общеобразовательным программам” Федерального закона от 29.12.2012 N 273-ФЗ “Об образовании в Российской Федерации”
(ООО юридическая фирма “ЮРИНФОРМ ВМ”)Руководствуясь статьей 67 Федерального закона от 29 декабря 2012 г. N 273-ФЗ “Об образовании в РФ”, Порядком приема на обучение по образовательным программам дошкольного образования, утвержденным Приказом Минобрнауки России от 8 апреля 2014 года N 293, учитывая, что орган местного самоуправления надлежащим образом исполнил возложенные на него функции, поскольку несовершеннолетняя (дочь истца) поставлена в соответствующую очередь на предоставление места в детском саду, истцу в предоставлении мест в дошкольном образовательном учреждении не было отказано, не предоставление места в дошкольном образовательном учреждении связано с отсутствием свободных мест, апелляционный суд отказал в признании незаконным бездействия, выразившегося в непредоставлении места в муниципальном дошкольном образовательном учреждении, отметив, что количество групп в дошкольном образовательном учреждении и их наполняемость определяются в соответствии с действующим законодательством, с учетом санитарных норм и условий образовательного процесса, предельной наполняемости. Статьи, комментарии, ответы на вопросы: Наполняемость групп в дошкольных учреждениях Нормативные акты: Наполняемость групп в дошкольных учреждениях Открыть документ в вашей системе КонсультантПлюс:
“Отраслевое соглашение по организациям, находящимся в ведении Министерства просвещения Российской Федерации, на 2021 – 2023 годы”
(вместе с “Рекомендациями о закреплении в региональных и территориальных соглашениях, в коллективных договорах положений об оплате труда педагогических работников с учетом имеющейся квалификационной категории за выполнение педагогической работы по должности с другим наименованием, по которой не установлена квалификационная категория, а также в других случаях”)
(утв. Минпросвещения России, Профсоюзом работников народного образования и науки РФ)а) превышение наполняемости классов, дошкольных групп, исчисляемой исходя из расчета соблюдения нормы площади на одного обучающегося (ребенка), а также иных санитарно-эпидемиологических требований к условиям и организации обучения в общеобразовательных учреждениях и (или) к устройству, содержанию и организации режима работы дошкольных образовательных организаций;
СанПиН для дошкольных учреждений \ Акты, образцы, формы, договоры \ Консультант Плюс
]]>Подборка наиболее важных документов по запросу СанПиН для дошкольных учреждений (нормативно–правовые акты, формы, статьи, консультации экспертов и многое другое).
Статьи, комментарии, ответы на вопросы: СанПиН для дошкольных учреждений Открыть документ в вашей системе КонсультантПлюс:“Комментарий к Федеральному закону от 29 декабря 2012 г. N 273-ФЗ “Об образовании в Российской Федерации”
(постатейный)
(Барабанова С.В., Пешкова (Белогорцева) Х.В., Баранов И.В., Менкенов А.В., Селезнева А.Х., Чернусь Н.Ю., Беляев М.А., Зенков М.Ю., Котухов С.А.)
(Подготовлен для системы КонсультантПлюс, 2019)Вместе с тем, указал суд, меры охраны здоровья, предусмотренные комментируемым Законом, содержат в своем перечне и иные виды медицинской помощи, организация которых (за исключением оказания первичной медико-санитарной помощи, прохождения периодических медицинских осмотров и диспансеризации), в силу ч. 2 ст. 41 возложена непосредственно на учреждения, осуществляющие образовательную деятельность. Так, в соответствии с Санитарно-эпидемиологическими требованиями к устройству, содержанию и организации режима работы в дошкольных организациях, утв. Постановлением Главного государственного санитарного врача Российской Федерации от 15 мая 2013 г. N 26 (СанПиН 2.4.1.3049-13), в целях охраны здоровья детей, их полноценного воспитания, обучения и развития предусмотрены основные гигиенические и противоэпидемические мероприятия, обязанность по организации которых лежит на дошкольном учреждении. Указанные мероприятия согласно требованиям раздела XVIII СанПиН 2.4.1.3049-13 проводятся в дошкольных образовательных учреждениях только медицинскими работниками. Исходя из изложенного, суд принял решение об обязании образовательного учреждения обеспечить в полном объеме медицинское обслуживание воспитанников данного учреждения в рамках имеющейся лицензии с включением в штат образовательного учреждения медицинского работника (см. Определение Приморского краевого суда от 15 декабря 2015 г. по делу N 33-11499/2015). Открыть документ в вашей системе КонсультантПлюс:
Статья: Поверка средств измерений
(Подготовлен для системы КонсультантПлюс, 2021)- средства измерений, применяемые для измерений характеристик среды обитания в детских дошкольных и других образовательных учреждениях, соблюдения в них санитарных правил и норм, а также для измерения характеристик среды в стерильных палатах и боксах лечебных учреждений; Нормативные акты: СанПиН для дошкольных учреждений
Дети с ОВЗ в ДОУ — Услуги —Детский сад комбинированного вида №82
Термин «дети с ОВЗ в детских садах» появился недавно. Это правовое понятие ввёл принятый в 2012 году и вступивший в силу 1 сентября 2013 года закон «Об образовании в Российской Федерации».
• Кого этот закон относит к обучающимся с ограниченными возможностями здоровья?
• Как строить работу с детьми с ОВЗ в ДОУ?
• Каким образом организовать обучение детей с ограниченными возможностями в дошкольных организациях?
В материале эти вопросы рассматриваются со всех сторон. Особое внимание в статье уделено адаптированным образовательным программам для детей с ОВЗ, которые используются для группы, для класса детей, у которых есть то или иное нарушение здоровья.
Федеральный закон определяет обучающихся с ограниченными возможностями здоровья как физических лиц, имеющих недостатки в физическом и (или) психологическом развитии, подтверждённые заключением психолого-медико-педагогической комиссии и препятствующие получению образования без создания специальных условий. Получение заключения ПМПК – важнейший этап в подтверждении статуса ребёнка с ОВЗ.
Рассмотрим пример:
В дошкольную образовательную организацию приходит мама и говорит о том, что ребёнок имеет ограниченные возможности здоровья. Но подкрепляющий устные заявления документ из ПМПК семья предъявить не может. В этом случае ребёнок не может быть определён в группу компенсирующей или комбинированной направленности.
Даже в случае, если педагоги и психологи детского сада видят, что конкретный ребёнок нуждается в коррекционной помощи, семья обязана посетить ПМПК и получить заключение комиссии.
Это интересно:
Психолого-педагогическое сопровождение инклюзивного образования территориальной ПМПК
Следует отметить, что психолого-медико-педагогическая комиссия работает в двух направлениях:
– обследует детей,
– даёт рекомендации по оказанию детям психолого-медико-педагогической помощи и созданию для них условий в образовательных организациях.
Сотрудники ПМПК знают и понимают, что в рекомендациях обязательно нужно отразить те условия, которые необходимо организовать для обучения ребёнка с ОВЗ в ДОУ по ФГОС с использованием адаптированной образовательной программы для детей с ОВЗ – либо основной, либо индивидуальной. Довольно часто ПМПК рекомендует родителям определить ребёнка с ограниченными возможностями здоровья в группу компенсирующей направленности или группу комбинированной направленности, где осуществляется инклюзивное образование. Такой подход позволяет активнее включать детей с ограниченными возможностями здоровья в жизнь социума и прививать им навыки общения.
Организация инклюзивного обучения детей с ограниченными возможностями здоровья
Термин «инклюзивное образование», имеющий самое непосредственное отношение к обучению детей с ограниченными возможностями здоровья, в нормативной базе Российской Федерации впервые появился в 2012 году, ранее ни в одном документе федерального уровня такого понятия не было.
Знаете ли вы?
В законе «Об образовании» вводится следующее определение: «Инклюзивное образование – обеспечение равного доступа к образованию для всех обучающихся с учетом разнообразия особых образовательных потребностей и индивидуальных возможностей».
Несмотря на то, что это понятие появилось совсем недавно, инклюзивное образование уже прочно вошло в нашу жизнь, оно реализуется и в дошкольных образовательных организациях реализуется, и на уровне начального общего и основного общего образования, и в высшем профессиональном, и в среднем профессиональном образовании. В зависимости от рекомендаций психолого-медико-педагогической комиссии детей с ОВЗ в детский сад могут принять:
– в группу компенсирующей направленности,
– в группу комбинированной направленности.
В чём заключаются особенности образовательного процесса в этих группах?
1. Инклюзивное образование в ДОУ в группах комбинированной направленности Группы комбинированной направленности сложно назвать новаторской новинкой, дошкольное образование в таких группах было и до принятия закона, когда в обычные детские коллективы включались дети с небольшими проблемами здоровья (пониженным зрением, лёгкой степенью глухоты и пр.). Особенность групп комбинированной направленности состоит в том, что в них наряду с нормально развивающимися дошкольниками совместно обучаются дети, у которых есть те или иные виды нарушений (нарушения зрения, нарушения слуха, нарушения речи, задержка психического развития, нарушения опорно-двигательного аппарата и так далее). В отличие от наполняемости групп общеразвивающей направленности, которая зависит от площади помещения, наполняемость групп комбинированной направленности регламентируется СанПиНом. В СанПиНах же указывается, сколько детей с ОВЗ может быть в такой группе. Как правило, программы, которые используют педагоги в таких группах, тоже уже прошли достаточно широкую апробацию и внедрены в педагогическую практику, в образовательный процесс, однако методы обучения детей с ОВЗ в ДОУ по ФГОС в этих группах отличаются. Вне зависимости от числа таких воспитанников (это могут быть два, три, четыре, пять, семь человек) педагог в работе с ними использует адаптированную образовательную программу, причём для каждого ребёнка свою.
Знаете ли вы?
Одну программу допускается использовать только в том случае, если группу посещают дети с аналогичным видом нарушений.
Например, если два-три человека имеют одинаковую степень тугоухости, то адаптированная программа может быть единой. Если же в коллективе разные дети, особенно разные по видам нарушений, например, один ребёнок – с нарушением слуха, другой – с нарушением зрения, третий – с нарушением психического развития, тогда для каждого ребёнка в индивидуальном порядке прописывается адаптированная образовательная программа для ребёнка с ограниченными возможностями здоровья.
2. Инклюзивное образование в группах компенсирующей направленности Группы компенсирующей направленности – это группы, которые посещают дети с одним и тем же нарушением. Например, группы для детей с нарушениями слуха, или группы для детей с нарушениями зрения, или группы для детей с нарушениями речи, и так далее. Закон «Об образовании» впервые ввёл в перечень детей с ограниченными возможностями здоровья также детей с расстройствами аутистического спектра, чего не было ранее в типовом положении. Такая группа детей с ОВЗ появилась впервые. К сожалению, в последние годы детей с ранним детским аутизмом действительно стало много, в новом тысячелетии медики стали активно диагностировать это заболевание. Дети-аутисты нуждаются в особых условиях получения образования, и именно поэтому они также подпадают под определение детей с ограниченными возможностями здоровья. Исходя из особенностей воспитанников, группы компенсирующей направленности могут иметь 10 направленностей – в зависимости от категории детей. В группах реализуется адаптированная основная образовательная программа, единственная адаптированная основная образовательная программа. И это – одна из главных сложностей реализации инклюзивного образования детей с ОВЗ в ДОУ в группах компенсирующей направленности. Дело в том, что примерных адаптированных основных образовательных программ, с учётом которых можно написать собственно адаптированную основную образовательную программу, пока на ФГОС-реестр не вывешено, к настоящему моменту они не разработаны. Есть только федеральный государственный образовательный стандарт, на основе которого они пишутся, но на основе этого документа дошкольным организациям достаточно сложно создавать адаптированные основные образовательные программы.
Подготовка детского сада к инклюзивному образованию
Наше государство гарантирует равные возможности для полноценного развития все гражданам, включая имеющих проблемы со здоровьем. Безусловно, каждому ребёнку нужно попасть в нужное время и в нужное место, то есть в тот самый сад, где ему будет комфортно. В особенности это относится к детям с ограниченными возможностями здоровья. Родителям не всегда удаётся получить путёвку в ту дошкольную организацию, где для такого ребёнка созданы условия. И если мама получает путёвку в общеразвивающую группу, а в образовательной организации нет нужного специалиста (психолога, логопеда, дефектолога), а ребёнку он категорически нужен по заключению ПМПК, то складывается двоякая ситуация. Со стороны кажется, что ребёнок охвачен дошкольным образованием. Но получает ли он именно то образование, которое ему необходимо? Отнюдь нет. Получает ли он именно тот набор условий, которые ему необходимы? Опять же нет.
Знаете ли вы?
Как только в детском саду появляются дети, предоставившие подтверждение психолого-медико-педагогической комиссии, заключение ПМПК о статусе «ребёнок с ограниченными возможностями здоровья», это сразу нацеливает образовательную организацию на создание для такого ребёнка специальных образовательных условий.
А специальные образовательные условия – это не только пандусы, поручни и какие-то другие архитектурно-планировочные вещи. К специальным образовательным условиям следует отнести:
– повышение квалификации педагогов, обучение педагогов, их подготовка к работе с детьми c ОВЗ;
– методическую составляющую;
– изменения в образовательной программе, то есть возникновение определённого раздела в основной образовательной программе, который ФГОС определяет как «коррекционная работа/инклюзивное образование».
Таким образом, у дошкольной организации возникает довольно много серьёзных проблем, которые необходимо решать.
Здесь следует напомнить, что подготовка педагогических работников, владеющих специальными педагогическими подходами и методами обучения, – это прерогатива субъекта Российской Федерации. То есть орган государственной власти субъекта должен беспокоиться о подготовке данных педагогических работников, с одной стороны, и содействовать привлечению таких работников в организации, с другой стороны.
Сегодня педагогические вузы в своих программах уделяют внимание образованию детей с ОВЗ, студентам предлагаются циклы лекций по этой теме. Но времени в вузовской программе на изучение этой многогранной проблемы выделяется очень мало, глубина её проработки недостаточна для полноценной подготовки педагогов дошкольного образования к работе с детьми с ОВЗ в ДОУ. Будущим воспитателям даются только общие сведения о диагностике и какие-то отдельные отрывочные сведения о коррекции. Собственно методов работы с детьми с ОВЗ в ДОУ, приёмов работы, методик и технологий студенты и выпускники не изучают и навыков такой работы не получают. Поэтому воспитатель, который приходит в группу общеразвивающей направленности после педагогического колледжа, не готов, не владеет навыками, умениями, этими компетенциями, которые ему необходимы.
Нельзя не сказать, что сегодня наше общество постоянно сталкивается с оптимизацией процессов и условий. Тяжёлой проблемой во многих регионах становится увольнение логопедов, психологов, дефектологов. Федеральные и региональные власти объясняют это снижением финансирования и оптимизацией расходов. Но отсутствие столь нужных специалистов в детских садах не позволяет в полной мере реализовывать образовательную программу для всех детей. Получается, что для одних категорий воспитанников она может быть реализована, а для других – нет. Однако при таком подходе становится невозможным исполнение закона «Об образовании» и федерального государственного образовательного стандарта. И, разумеется, никак не исполняется социальный запрос со стороны родителей, что немаловажно.
Адаптированные образовательные программы для детей с ОВЗ
Хотя внедрение инклюзивного образования связано с массой сложностей, процесс происходит всё активнее. Для детей с ОВЗ в детских садах создаётся доступная среда, педагоги осваивают методики взаимодействия с такими дошкольниками. И сегодня на первый план выходит вопрос разработки основных образовательных программ. Базисом при написании программы служит федеральный государственный образовательный стандарт, на основе которого и пишется программа. Но не менее важно, чтобы основная образовательная программа была разработана с учётом примерной. Этого требует закон «Об образовании», поэтому так поступают все образовательные организации (и дошкольные в том числе) при разработке основных образовательных программ.
Знаете ли вы?
На сегодняшний день примерных адаптированных основных образовательных программ дошкольных пока нет. Они не разработаны, на сайте ФГОС-реестра их нет, и взять их неоткуда.
Это довольно серьёзная проблема, которая существенно тормозит развитие системы дошкольного образования в части дошкольного образования детей с ограниченными возможностями здоровья. Нельзя забывать, что в группах, где есть дети с ограниченными возможностями здоровья, для обучения должны использоваться программы адаптированные, хотя они могут между собой различаться. Этот момент стоит отметить особо. Ранее не существовало понятия «адаптированная программа», хотя термин «коррекционная программа» используется уже давно.
Адаптированные основные общеобразовательные программы – это ещё одно нововведение в системе образования, в том числе дошкольного. Это программы, которые используются для группы, для класса детей, у которых есть то или иное нарушение. Например, адаптированная основная общеобразовательная программа для группы детей слабовидящих или для детей слабослышащих, для детей слепых, для детей глухих, для детей с тяжёлыми нарушениями речи. Таких детских групп в стране очень много, и эти группы и должны работать по адаптированным основным программам.
Что же представляют собой адаптированные образовательные программы для детей с ОВЗ?
Без такой программы не обойтись в том случае, когда в группе нормально развивающихся сверстников есть один, двое, трое, пятеро детей с ограниченными возможностями здоровья.
Сегодня в дошкольных организациях используются различные программы, в их числе программы:
«От рождения до школы»,
«Детство»,
«Радуга» и пр.
Но для ребёнка с ОЗВ, любого ребёнка с любым нарушением ни одна из этих программ не подходит. А если программа не подходит, то её надлежит адаптировать.
Рассмотрим пример
Ребёнок с тяжёлыми нарушениями речи попадает в комбинированную группу. Для такого ребёнка необходимо адаптировать раздел программы, который называется «Развитие речи». Для такого ребёнка необходимо внести в содержание программы определённые изменения, именно те, которые необходимы этому конкретному ребёнку, исходя из того, какая у него лексическая недостаточность (то есть чего у него недостаёт в плане лексики), есть ли у него нарушения грамматического строя речи (и если есть, то какие), что у этого ребёнка со звукопроизношением. Таким образом, образовательная программа адаптируется, чтобы процесс обучения ребёнка с ограниченными возможностями здоровья был более комфортным и приводил к достижению высоких результатов.
Это интересно:
Нужно ли вносить изменения в устав в случае обучения детей с ОВЗ по адаптированным образовательным программам
И для родителей, и для воспитателей очевидно, что детям с ограниченными возможностями здоровья намного легче адаптироваться и осваивать образовательные программы в группах комбинированной направленности. И здесь важнее, чем когда-либо, говорить о программах адаптированных. Каждому ребёнку с ОВЗ, который попал в группу комбинированной направленности, необходимо садаптировать основную программу, которая предлагается для всей группы. Бесспорно, для конкретного ребёнка требуется индивидуальная адаптация этой программы. Возможно, только в одной образовательной области, как, например, для детей с тяжёлыми нарушениями речи. Возможно, в двух областях, если, например, это дети с задержкой психического развития. Особенности адаптации зависят от образовательных потребностей каждого ребёнка, который оказывается в группе здоровых сверстников. И, пожалуй, два момента – разработка адаптированной образовательной программы для каждого ребёнка с ОВЗ в группах комбинированной направленности и в разработке адаптированных основных образовательных программ – и представляют на сегодня главную сложность в инклюзивном образовании детей с ограниченными возможностями здоровья.
Но, несмотря на все трудности внедрения инклюзивного образования, такой подход к обучению детей с ОВЗ в ДОУ имеет широчайшие перспективы. Постоянное взаимодействие и ежедневное сотрудничество позволяет и детям с ограниченными возможностями здоровья, и детям с нормальным развитием приобрести новые знания и навыки, стать более толерантными, научиться изыскивать решения в самых разных жизненных ситуациях. Глобальная цель инклюзивного образования – создание комфортных условий для совместного успешного воспитания и результативного образования детей с разными психофизическими особенностями развития. И первый шаг к достижению этой цели наше общество уже сделало.
Источник: https://www.resobr.ru/deti-s-ovz-v-dou?ustp=W
Любое использование материалов допускается только при наличии гиперссылки.
Нормы по количеству детей в комбинированных группах детского сада
Здравствуйте! Мой ребенок ходит в старшую группу специализированного офтальмологического детского сада. В последнее время в нашу группу стали добавлять здоровых детей, то есть группа у нас стала смешанной. Сейчас в группе уже 17 человек и один воспитатель. Подскажите, пожалуйста, каковы нормы по количеству детей в смешанных группах и не нарушены ли они в нашей группе?
Согласно СанПиН 2.4.1.3049-13 рекомендуемая наполняемость на одного воспитателя для групп комбинированной направленности устанавливается в зависимости от категории детей с ограниченными возможностями здоровья (ОВЗ) и возраста детей в группе.
Для младших групп (до 3 лет) рекомендуемое количество детей в группе составляет не более 10 детей, из них не более 3 детей с ограниченными возможностями здоровья.
Для групп старше 3 лет рекомендуемое количество детей в группе составляет:
– не более 10 детей, в том числе не более 3 глухих детей, или слепых детей, или детей с нарушениями опорно-двигательного аппарата, или детей с умственной отсталостью умеренной, тяжелой, или детей со сложным дефектом;
– не более 15 детей, в том числе не более 4 слабовидящих и (или) детей с амблиопией и косоглазием, или слабослышащих детей, или детей, имеющих тяжелые нарушения речи, или детей с умственной отсталостью легкой степени;
– не более 17 детей, в том числе не более 5 детей с задержкой психического развития.
К сожалению, вы не указали категорию, к которой относится ваш ребенок, поэтому мы не можем дать вам точный ответ на вопрос, нарушены ли нормы в вашей группе. Но вы можете сделать такой вывод, исходя из приведенных нами законодательно установленных рекомендуемых норм.
Чтобы узнать нормативы, действующие в конкретном детском садике, куда ходит ваш ребенок, следует поговорить с его заведующей и попросить ее дать вам ознакомиться с уставом детского сада, в котором это должно быть закреплено. Отказать в ознакомлении с положениями устава вам не имеют права. И если нормативы, закрепленные в уставе детского сада, нарушены, вы имеете полное право требовать у данного учреждения ответа перед законом.
Помощь Беременным женщинам и мамам
Бесплатная горячая линия в сложной жизненной ситуации
8 800 222 05 45| Функциональный ключ | Позиция (я) | Описание Действия | Графическое представление | Длина |
|---|---|---|---|---|
|
В этом подразделе раздела PTM / Processing указано, что метионин инициатора отщепляется от зрелого белка. . Инициатор метионин i | Удалено
Подтвержденная вручную информация, полученная на основе экспериментальных и расчетных данных. Утверждение, сделанное вручную, выведено из комбинации экспериментальных и расчетных данных i
| |||
|
В этом подразделе раздела «PTM / Обработка» описывается протяженность полипептидной цепи в зрелом белке после процессинга или протеолитического расщепления. Цепочка i PRO_0000097556 | 2 – 136 | SNARE-связанный белок SnapinAdd BLAST | 135 | |
| Функциональный ключ | Позиция (я) | Описание Действия | Графический вид | Длина |
|
В этом подразделе раздела “PTM / Обработка” указываются положение и тип каждого измененного остатка, за исключением lipids , гликаны и перекрестные ссылки протеина . Подробнее … Модифицированный остаток i | 2 | N-ацетилаланин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
| 1 | |
| Модифицированный остаток i | 10 | Фосфосерин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
| 1 | |
| Модифицированный остаток i | 14 | Фосфотреонин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i
| 1 | |
| Модифицированный остаток i | 50 | Фосфосерин; по PKA Ручное утверждение, выведенное из сходства последовательностей с i | 1 | |
| Модифицированный остаток i | 126 | Фосфосерин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 1 | |
| Модифицированный остаток i | 129 | Фосфотирозин Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 1 | |
| Модифицированный остаток i | 133 | Фосфосерин Ручное утверждение, выведенное из комбинации экспериментальных и компьютерных данных i
| 1 |
Известные проблемы с репликой хранилища
- 19 минут для чтения
В этой статье
Применимо к: Windows Server 2022, Windows Server 2019, Windows Server 2016
В этом разделе обсуждаются известные проблемы с репликой хранилища в Windows Server.
После удаления репликации диски отключены, и вы не можете снова настроить репликацию
В Windows Server 2016 может оказаться невозможным подготовить репликацию на томе, который ранее был реплицирован, или могут быть обнаружены неподдающиеся монтированию тома. Это может произойти, когда некоторая ошибка препятствует удалению репликации или когда вы переустанавливаете операционную систему на компьютере, который ранее реплицировал данные.
Для исправления необходимо очистить скрытый раздел реплики хранилища с дисков и вернуть их в доступное для записи состояние с помощью командлета Clear-SRMetadata .
-
Чтобы удалить все осиротевшие слоты баз данных разделов реплики хранилища и перемонтировать все разделы, используйте параметр
-AllPartitionsследующим образом:Очистить-SRMetadata -AllPartitions -
Чтобы удалить все потерянные данные журнала реплики хранилища, используйте параметр
-AllLogsследующим образом:Clear-SRMetadata -AllLogs -
Чтобы удалить все данные конфигурации потерянного отказоустойчивого кластера, используйте параметр
-AllConfigurationследующим образом:Clear-SRMetadata -AllConfiguration -
Чтобы удалить метаданные отдельной группы репликации, используйте параметр
-Nameи укажите группу репликации следующим образом:Clear-SRMetadata -Name RG01 -Logs -Partition
Серверу может потребоваться перезагрузка после очистки базы данных раздела; вы можете временно подавить это с помощью -NoRestart , но вы не должны пропускать перезапуск сервера по запросу командлета.Этот командлет не удаляет тома данных или данные, содержащиеся в этих томах.
Во время начальной синхронизации см. Журнал событий 4004 предупреждений
В Windows Server 2016 при настройке репликации и исходный, и целевой серверы могут отображать несколько ** StorageReplica \ Admin * – журнал событий 4004 предупреждений каждый во время начальной синхронизации со статусом «недостаточно системных ресурсов для завершения API». Вы также можете увидеть ошибку 5014. Это указывает на то, что серверам не хватает доступной памяти (ОЗУ) для выполнения как начальной синхронизации, так и выполнения рабочих нагрузок.Либо добавьте ОЗУ, либо уменьшите объем используемой ОЗУ из функций и приложений, отличных от реплики хранилища.
При использовании гостевых кластеров с общим VHDX и хоста без CSV виртуальные машины перестают отвечать после настройки репликации
В Windows Server 2016 при использовании гостевых кластеров Hyper-V для тестирования или демонстрации реплики хранилища и использовании общего VHDX в качестве хранилища гостевого кластера виртуальные машины перестают отвечать после настройки репликации. Если вы перезапустите хост Hyper-V, виртуальные машины начнут отвечать, но настройка репликации не будет завершена, и репликация не произойдет.
Это происходит, когда вы используете ** fltmc.exe attach svhdxflt * – чтобы обойти требование для хоста Hyper-V, на котором запущен CSV. Использование этой команды не поддерживается и предназначено только для тестовых и демонстрационных целей.
Причина замедления – это проблема взаимодействия по проекту между функцией QoS хранилища в Windows Server 2016 и вручную подключенным фильтром Shared VHDX. Чтобы решить эту проблему, отключите драйвер фильтра QoS хранилища и перезапустите хост Hyper-V:
SC config storqosflt start = отключено
Невозможно настроить репликацию при использовании New-Volume и другого хранилища
При использовании командлета New-Volume вместе с разными наборами хранилищ на исходном и конечном сервере, например двух разных SAN или двух JBOD с разными дисками, вы не сможете впоследствии настроить репликацию с помощью New-SRPartnership .Показанная ошибка может включать:
Размеры разделов данных в этих двух группах различаются
Используйте командлет New-Partition ** для создания томов и форматирования их вместо New-Volume , поскольку последний командлет может округлять размер тома на разных массивах хранения. Если вы уже создали том NTFS, вы можете использовать Resize-Partition для увеличения или уменьшения одного из томов, чтобы он соответствовал другому (это невозможно сделать с томами ReFS).При использовании ** Diskmgmt * – или Server Manager округление не происходит.
При попытке использовать Test-SRTopology вы получаете одну из следующих ошибок:
ПРИМЕР ОШИБКИ 1:
ПРЕДУПРЕЖДЕНИЕ. Введено недопустимое значение для имени целевого компьютера: sr-srv03. Командлет Test-SrTopology не принимает IP-адрес в качестве входных данных для параметра имени целевого компьютера. Имена NetBIOS и полностью определенные доменные имена являются допустимыми входными данными.
Система оповещения.Исключение
ВНИМАНИЕ: в Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand.BeginProcessing ()
Test-SRTopology: Введено недопустимое значение для имени целевого компьютера: sr-srv03. Командлет Test-SrTopology не принимает IP-адрес в качестве входных данных для параметра имени целевого компьютера. Имена NetBIOS и полностью определенные доменные имена являются допустимыми входными данными.
В строке: 1 символ: 1
+ Test-SRTopology -SourceComputerName sr-srv01 -SourceVolumeName d: -Так ...
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: InvalidArgument: (:) [Test-SRTopology], Exception
+ FullyQualifiedErrorId: TestSRTopologyFailure, Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand
ПРИМЕР ОШИБКИ 2:
ПРЕДУПРЕЖДЕНИЕ. Введено недопустимое значение для имени исходного компьютера.
ПРИМЕР ОШИБКИ 3:
Указанный том не может быть найден G: не может быть найден на компьютере SRCLUSTERNODE1
Этот командлет имеет ограниченное количество отчетов об ошибках в Windows Server 2016 и возвращает те же выходные данные для многих распространенных проблем. Ошибка может появиться по следующим причинам:
-
Вы вошли в систему на исходном компьютере как локальный пользователь, а не как пользователь домена.
-
Конечный компьютер не работает или недоступен по сети.
-
Вы указали неправильное имя для конечного компьютера.
-
Вы указали IP-адрес для целевого сервера.
-
Брандмауэр конечного компьютера блокирует доступ к вызовам PowerShell и / или CIM.
-
На конечном компьютере не запущена служба WMI.
-
Вы не использовали CREDSSP при удаленном запуске командлета
Test-SRTopologyс управляющего компьютера. -
Указанный исходный или целевой том – это локальные диски на узле кластера, а не кластерные диски.
Настройка нового партнерства реплики хранилища возвращает ошибку – «Не удалось подготовить раздел»
При попытке создать новое партнерство репликации с New-SRPartnership , вы получаете следующую ошибку:
New-SRPartnership: невозможно создать группу репликации test01, подробная причина: не удалось подготовить раздел ed0dc93f-107c-4ab4-a785-afd687d3e734.В строке: 1 символ: 1
+ New-SRPartnership -SourceComputerName srv1 -SourceRGName test01
+ Categorylnfo: ObjectNotFound: (MSFT_WvrAdminTasks: root / Microsoft /.. S) CNew-SRPartnership], CimException
+ FullyQua1ifiedErrorId: системная ошибка Windows 1168, New-SRPartnership
Это вызвано выбором тома данных, который находится в том же разделе, что и системный диск (т. Е. ** C: – диск с его папкой Windows). Например, на диске, который содержит оба тома ** C: – и ** D: *, созданные из одного раздела.Это не поддерживается в реплике хранилища; вы должны выбрать другой том для репликации.
Попытка увеличить реплицированный том не удалась из-за отсутствия обновления
При попытке увеличить или расширить реплицированный том появляется следующая ошибка:
Изменение размера раздела - Буква d - Размер 44 ГБ
Resize-Partition: операция завершилась неудачно с кодом возврата 8
В строке: 1 символ: 1
+ Изменение размера раздела -DriveLetter d-Размер 44GB
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: NotSpecified: (StorageWMI: ROOT / Microsoft /.../MSFT_Partition
[Изменение размера раздела], CimException
+ FullyQualifiedErrorId: StorageWMI 8, изменение размера раздела
При использовании оснастки MMC управления дисками появляется следующая ошибка:
Элемент не найден
Это происходит, даже если вы правильно включили изменение размера тома на исходном сервере с помощью Set-SRGroup -Name rg01 -AllowVolumeResize $ TRUE .
Эта проблема была исправлена в накопительном обновлении для Windows 10 версии 1607 (юбилейное обновление) и Windows Server 2016: 9 декабря 2016 г. (KB3201845).
Попытка увеличить реплицированный том не удалась из-за отсутствия шага
Если вы попытаетесь изменить размер реплицированного тома на исходном сервере, не задав сначала -AllowResizeVolume $ TRUE , вы получите следующие ошибки:
Изменение размера раздела - Буква I - Размер 8 ГБ
Изменение размера раздела: сбой
Идентификатор действия: {87aebbd6-4f47-4621-8aa4-5328dfa6c3be}
В строке: 1 символ: 1
+ Изменение размера раздела -DriveLetter I-Размер 8 ГБ
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: NotSpecified: (StorageWMI: ROOT / Microsoft /.../MSFT_Partition) [Изменение размера раздела], CimException
+ FullyQualifiedErrorId: StorageWMI 4, изменение размера раздела
Ошибка журнала событий реплики хранилища 10307:
Попытка изменить размер раздела, защищенного репликой хранилища.
Имя устройства: \ Устройство \ Harddisk1 \ DR1
PartitionNumber: 7
PartitionId: {b71a79ca-0efe-4f9a-a2b9-3ed4084a1822}
Руководство: Чтобы увеличить раздел исходных данных, установите политику для группы репликации, содержащей раздел данных.
Set-SRGroup -ComputerName [ComputerName] -Name [ReplicationGroupName] -AllowVolumeResize $ true
Перед тем, как вы увеличиваете исходный раздел данных, убедитесь, что у целевого раздела данных достаточно места, чтобы вырасти до такого же размера.Сжатие раздела данных, защищенного репликой хранилища, заблокировано.
Ошибка оснастки управления дисками:
Произошла непредвиденная ошибка
После изменения размера тома не забудьте отключить изменение размера с помощью Set-SRGroup -Name rg01 -AllowVolumeResize $ FALSE . Этот параметр запрещает администраторам пытаться изменить размер тома до проверки наличия достаточного места на целевом томе, обычно потому, что они не знали о наличии реплики хранилища.
Попытка переместить ресурс PDR между сайтами в асинхронном растянутом кластере не удалась
При попытке переместить роль прикрепленного к ресурсу физического диска – такую как файловый сервер для общего использования – для перемещения связанного хранилища в асинхронном растянутом кластере вы получаете сообщение об ошибке.
При использовании оснастки диспетчера отказоустойчивого кластера:
Ошибка
Операция не удалась.
Действие «Перемещение» не завершено.
Код ошибки: 0x80071398
Операция завершилась неудачно, потому что либо указанный узел кластера не является владельцем группы, либо узел не является возможным владельцем группы.
При использовании командлета Cluster powershell:
Move-ClusterGroup -Name sr-fs-006 -Node sr-srv07
Move-ClusterGroup: произошла ошибка при перемещении кластерной роли sr-fs-006.Операция завершилась неудачно, потому что либо указанный узел кластера не является владельцем группы, либо узел не является возможным владельцем группы.
В строке: 1 символ: 1
+ Move-ClusterGroup -Name sr-fs-006 -Node sr-srv07
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: NotSpecified: (:) [Move-ClusterGroup], ClusterCmdletException
+ FullyQualifiedErrorId: Move-ClusterGroup, Microsoft.FailoverClusters.PowerShell.MoveClusterGroupCommand
Это происходит из-за нестандартного поведения в Windows Server 2016.Используйте Set-SRPartnership , чтобы переместить эти диски PDR в асинхронный растянутый кластер.
Это поведение было изменено в Windows Server версии 1709, чтобы разрешить ручное и автоматическое переключение при отказе с асинхронной репликацией на основе отзывов клиентов.
Попытка добавить диски в двухузловой асимметричный кластер возвращает «Диски, подходящие для дисков кластера, не найдены»
При попытке подготовить кластер только с двумя узлами перед добавлением растянутой репликации реплики хранилища вы пытаетесь добавить диски на втором сайте к Доступным дискам.Вы получаете следующую ошибку:
Диски, подходящие для дисков кластера, не найдены. Для получения диагностической информации о дисках, доступных для кластера, используйте мастер проверки конфигурации для запуска тестов хранилища.
Этого не происходит, если у вас есть по крайней мере три узла в кластере. Эта проблема возникает из-за изменения побочного кода в Windows Server 2016 для асимметричного поведения кластеризации хранилища.
Чтобы добавить хранилище, вы можете запустить следующую команду на узле на втором сайте:
Get-ClusterAvailableDisk -All | Добавить-ClusterDisk
Это не будет работать с локальным хранилищем узла.Реплику хранилища можно использовать для репликации растянутого кластера между двумя узлами, по каждый, используя свой собственный набор общего хранилища.
Ограничителю пропускной способности SMB не удается ограничить пропускную способность реплики хранилища
При указании ограничения пропускной способности для реплики хранилища ограничение игнорируется и используется полная пропускная способность. Например:
Set-SmbBandwidthLimit -Category StorageReplication -BytesPerSecond 32 МБ
Эта проблема возникает из-за проблемы взаимодействия между репликой хранилища и SMB.
Событие 1241: предупреждение повторяется во время начальной синхронизации
Если задано асинхронное партнерство репликации, исходный компьютер неоднократно регистрирует предупреждающее событие 1241 в канале администратора реплики хранилища. Например:
Имя журнала: Microsoft-Windows-StorageReplica / Admin
Источник: Microsoft-Windows-StorageReplica
Дата: 21.03.2017 15:10:41
ID события: 1241
Категория задачи: (1)
Уровень: Предупреждение
Ключевые слова: (1)
Пользователь: SYSTEM
Компьютер: sr-srv05.corp.contoso.com
Описание:
Целевая точка восстановления (RPO) асинхронного пункта назначения недоступна.
LocalReplicationGroupName: rg01
LocalReplicationGroupId: {e20b6c68-1758-4ce4-bd3b-84a5b5ef2a87}
LocalReplicaName: f: \
LocalPartitionId: {27484a49-0f62-4515-8588-3755a292657f}
ReplicaSetId: {1f6446b5-d5fd-4776-b29b-f235d97d8c63}
RemoteReplicationGroupName: rg02
RemoteReplicationGroupId: {7f18e5ea-53ca-4b50-989c-9ac6afb3cc81}
TargetRPO: 30
Руководство: Обычно это происходит по одной из следующих причин:
-
Асинхронный пункт назначения в настоящее время отключен.RPO может стать доступным после восстановления соединения.
-
Асинхронный пункт назначения не может идти в ногу с источником, поэтому самая последняя запись журнала назначения больше не присутствует в исходном журнале. Пункт назначения начнет копирование блока. RPO должен стать доступным после завершения копирования блока.
Это ожидаемое поведение во время начальной синхронизации, и его можно безопасно игнорировать. Это поведение может измениться в более позднем выпуске.Если вы видите такое поведение во время продолжающейся асинхронной репликации, исследуйте партнерство, чтобы определить, почему репликация задерживается сверх установленного вами RPO (30 секунд по умолчанию).
Предупреждение о событии 4004 повторяется после перезагрузки реплицированного узла
В редких и обычно невоспроизводимых обстоятельствах перезагрузка сервера, который находится в партнерстве, приводит к сбою репликации и событию 4004 предупреждения о перезагрузке узла с ошибкой отказа в доступе.
Имя журнала: Microsoft-Windows-StorageReplica / Admin
Источник: Microsoft-Windows-StorageReplica
Дата: 21.03.2017 11:43:25
Идентификатор события: 4004
Категория задачи: (7)
Уровень: Предупреждение
Ключевые слова: (256)
Пользователь: SYSTEM
Компьютер-сервер.contoso.com
Описание:
Не удалось установить соединение с удаленным компьютером.
RemoteComputerName: сервер
LocalReplicationGroupName: rg01
LocalReplicationGroupId: {a386f747-bcae-40ac-9f4b-1942eb4498a0}
RemoteReplicationGroupName: rg02
RemoteReplicationGroupId: {a386f747-bcae-40ac-9f4b-1942eb4498a0}
ReplicaSetId: {00000000-0000-0000-0000-000000000000}
RemoteShareName: {a386f747-bcae-40ac-9f4b-1942eb4498a0}. {00000000-0000-0000-0000-000000000000}.
Статус: {Доступ запрещен}
Процесс запросил доступ к объекту, но ему не были предоставлены эти права доступа.Рекомендации: Возможные причины включают сбои сети, сбои при создании общих ресурсов для удаленной группы репликации или настройки брандмауэра. Убедитесь, что трафик SMB разрешен и нет проблем с подключением между локальным и удаленным компьютерами. Это событие следует ожидать при приостановке репликации или удалении партнерства репликации.
Обратите внимание на статус : «{Доступ запрещен}» и сообщение Процесс запросил доступ к объекту, но не получил эти права доступа. Это известная проблема в реплике хранилища, которая была исправлена в обновлении качества от 12 сентября 2017 г. – KB4038782 (сборка ОС 14393.1715) https://support.microsoft.com/help/4038782/windows-10-update-kb4038782
Ошибка «Не удалось перевести ресурс« Cluster Disk x »в оперативный режим». с растяжкой
При попытке перевести диск кластера в оперативный режим после успешного перехода на другой ресурс, когда вы снова пытаетесь сделать исходный исходный сайт первичным, вы получаете сообщение об ошибке в диспетчере отказоустойчивого кластера.Например:
Ошибка
Операция не удалась.
Не удалось подключить ресурс «Диск кластера 2».
Код ошибки: 0x80071397
Операция завершилась неудачно, потому что либо указанный узел кластера не является владельцем ресурса, либо этот узел не является возможным владельцем ресурса.
Если вы попытаетесь переместить диск или CSV вручную, вы получите дополнительную ошибку. Например:
Ошибка
Операция не удалась.
Действие «Перемещение» не завершено.
Код ошибки: 0x8007138d
Узел кластера недоступен для этой операции
Эта проблема вызвана тем, что один или несколько неинициализированных дисков подключены к одному или нескольким узлам кластера.Чтобы решить эту проблему, инициализируйте все подключенное хранилище с помощью DiskMgmt.msc, DISKPART.EXE или командлета Initialize-Disk PowerShell.
Мы работаем над выпуском обновления, которое навсегда решит эту проблему. Если вы заинтересованы в помощи и у вас есть соглашение о поддержке Microsoft Premier, отправьте электронное письмо по адресу [email protected], чтобы мы могли работать с вами над заполнением запроса на резервное копирование.
Ошибка GPT при попытке создать новое партнерство SR
При запуске New-SRPartnership происходит сбой с ошибкой:
Тип макета диска для тома \\? \ Volume {GUID} \ не является допустимым макетом стиля GPT.New-SRPartnership: невозможно создать группу репликации SRG01, подробная причина: тип макета диска для тома
\\? \ Volume {GUID} \ не является допустимым макетом стиля GPT.
В строке: 1 символ: 1
+ New-SRPartnership -SourceComputerName nodesrc01 -SourceRGName SRG01 ...
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: NotSpecified: (MSFT_WvrAdminTasks: root / Microsoft / ... T_WvrAdminTasks) [New-SRPartnership], CimException
+ FullyQualifiedErrorId: системная ошибка Windows 5078, New-SRPartnership
В графическом интерфейсе диспетчера отказоустойчивого кластера нет возможности настроить репликацию для диска.
При запуске Test-SRTopology происходит сбой:
ПРЕДУПРЕЖДЕНИЕ: ссылка на объект не установлена на экземпляр объекта.
ВНИМАНИЕ: System.NullReferenceException
ВНИМАНИЕ: в Microsoft.FileServices.SR.Powershell.MSFTPartition.GetPartitionInStorageNodeByAccessPath (String AccessPath, String ComputerName, MIObject StorageNode)
в Microsoft.FileServices.SR.Powershell.Volume.GetVolume (String Path, String ComputerName)
в Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand.BeginProcessing ()
Test-SRTopology: Ссылка на объект не установлена на экземпляр объекта.
В строке: 1 символ: 1
+ Test-SRTopology -SourceComputerName nodesrc01 -SourceVolumeName U: - ...
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: InvalidArgument: (:) [Test-SRTopology], NullReferenceException
+ FullyQualifiedErrorId: TestSRTopologyFailure, Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand
Это вызвано тем, что функциональный уровень кластера по-прежнему установлен на Windows Server 2012 R2 (i.е. FL 8). Реплика хранилища должна возвращать здесь конкретную ошибку, но вместо этого возвращает неверное сопоставление ошибок.
Выполнить Get-Cluster | fl - на каждом узле.
Если ClusterFunctionalLevel = 9 , это версия Windows 2016 ClusterFunctionalLevel, необходимая для реализации реплики хранилища на этом узле.
Если ClusterFunctionalLevel не равен 9, ClusterFunctionalLevel необходимо будет обновить, чтобы реализовать реплику хранилища на этом узле.
Чтобы решить эту проблему, поднимите функциональный уровень кластера, запустив командлет PowerShell: Update-ClusterFunctionalLevel.
Небольшой неизвестный раздел, указанный в DISKMGMT для каждого реплицированного тома
При запуске оснастки «Управление дисками» (DISKMGMT.MSC) вы заметите в списке один или несколько томов без метки или буквы диска и размером 1 МБ. Вы можете удалить неизвестный том или получить:
Произошла непредвиденная ошибка
Такое поведение является преднамеренным. Это не том, а раздел. Реплика хранилища создает раздел размером 512 КБ в качестве слота базы данных для операций репликации (устаревшая версия DiskMgmt.msc округляет до ближайшего МБ). Наличие такого раздела для каждого реплицированного тома нормально и желательно. Когда вы больше не используете, вы можете удалить этот раздел размером 512 КБ; бывшие в употреблении удалить нельзя. Перегородка никогда не будет увеличиваться или уменьшаться. Если вы воссоздаете репликацию, мы рекомендуем оставить раздел, поскольку реплика хранилища потребует неиспользуемые.
Для просмотра подробностей используйте инструмент DISKPART или командлет Get-Partition. Эти разделы будут иметь тип GPT 558d43c5-a1ac-43c0-aac8-d1472b2923d1 .
Узел реплики хранилища зависает при создании моментальных снимков
При создании моментального снимка VSS (с помощью резервного копирования, VSSADMIN и т. Д.) Узел реплики хранилища зависает, и для восстановления необходимо принудительно перезапустить узел. Ошибки нет, просто жесткое зависание сервера.
Эта проблема возникает при создании снимка тома журнала VSS. Основная причина заключается в устаревшем аспекте VSS, а не в реплике хранилища. В результате при создании моментального снимка тома журнала реплики хранилища механизм очередей ввода-вывода VSS блокирует сервер.
Чтобы предотвратить такое поведение, не создавайте моментальные снимки томов журнала реплики хранилища. Нет необходимости делать снимки томов журналов реплики хранилища, так как эти журналы невозможно восстановить. Кроме того, том журнала никогда не должен содержать никаких других рабочих нагрузок, поэтому снимок в общем случае не требуется.
Увеличение задержки ввода-вывода при использовании прямых дисковых пространств с репликой хранилища
При использовании локальных дисковых пространств с кешем NVME или SSD вы видите большее, чем ожидалось, увеличение задержки при настройке репликации реплики хранилища между кластерами локальных дисковых пространств.Изменение задержки пропорционально намного выше, чем вы видите при использовании NVME и SSD в конфигурации производительность + емкость и без уровня жестких дисков или уровня емкости.
Эта проблема возникает из-за архитектурных ограничений в механизме журнала реплики хранилища в сочетании с чрезвычайно низкой задержкой NVME по сравнению с более медленными носителями. При использовании кэша Storage Spaces Direct все операции ввода-вывода журналов реплики хранилища вместе со всеми последними операциями чтения / записи приложений будут происходить в кэше, а не на уровнях производительности или емкости.Это означает, что все действия реплики хранилища происходят на одном и том же быстродействующем носителе – эта конфигурация поддерживается, но не рекомендуется (рекомендации по журналам см. На https://aka.ms/srfaq).
При использовании локальных дисковых пространств с жесткими дисками нельзя отключить кэш или избежать кеширования. В качестве обходного пути, если вы используете только SSD и NVME, вы можете настроить только уровни производительности и емкости. При использовании этой конфигурации и размещении журналов SR на уровне производительности только с томами данных, которые они обслуживают, только на уровне емкости, вы избежите проблемы с высокой задержкой, описанной выше.То же самое можно сделать с сочетанием более быстрых и медленных твердотельных накопителей без использования NVME.
Этот обходной путь, конечно, не идеален, и некоторые клиенты могут не использовать его. Команда Storage Replica работает над оптимизацией и обновлением механизма журналов в будущем, чтобы уменьшить эти искусственные узкие места. Этот журнал v1.1 впервые стал доступен в Windows Server 2019, и его улучшенная производительность описана в блоге Server Storage.
Ошибка «Не удалось найти файл» при запуске Test-SRTopology между двумя кластерами
При запуске Test-SRTopology между двумя кластерами и их путями CSV происходит сбой с ошибкой:
PS C: \ Windows \ system32> Test-SRTopology -SourceComputerName NedClusterA -SourceVolumeName C: \ ClusterStorage \ Volume1 -SourceLogVolumeName L: -DestinationComputerName NedClusterB -DestinationVolumeNameResponse: \ ClusterStorage: \ Temp
Проверка объемов данных и журналов...
Измерение производительности восстановления реплики хранилища и начальной синхронизации ...
ВНИМАНИЕ: не удалось найти файл '\\ NedNode1 \ C $ \ CLUSTERSTORAGE \ VOLUME1TestSRTopologyRecoveryTest \ SRRecoveryTestFile01.txt'.
ВНИМАНИЕ: System.IO.FileNotFoundException
ВНИМАНИЕ: в System.IO .__ Error.WinIOError (код ошибки Int32, String может бытьFullPath)
в System.IO.FileStream.Init (строковый путь, режим FileMode, доступ к FileAccess, права Int32, логические права использования, общий ресурс FileShare, Int32 bufferSize, параметры FileOptions, SECURITY_ATTRIBUTES secAttrs, String msgPath, Boolean bFromProxy, Boolean useLongPath, Boolean System checkPath) .IO.FileStream..ctor (строковый путь, режим FileMode, доступ к FileAccess, общий ресурс FileShare, Int32 bufferSize, параметры FileOptions) в Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand.GenerateWriteIOWorkload (String Path, UInt32 IoSizeInBytes, UInt32 Parallel ) в Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand. <> c__DisplayClass75_0. b__0 () в System.Threading.Tasks.Task.Execute ()
Test-SRTopology: не удалось найти файл '\\ NedNode1 \ C $ \ CLUSTERSTORAGE \ VOLUME1TestSRTopologyRecoveryTest \ SRRecoveryTestFile01.текст'.
В строке: 1 символ: 1
+ Test-SRTopology -SourceComputerName NedClusterA -SourceVolumeName ...
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: ObjectNotFound: (:) [Test-SRTopology], FileNotFoundException
+ FullyQualifiedErrorId: TestSRTopologyFailure, Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand
Это вызвано известным дефектом кода в Windows Server 2016. Впервые эта проблема была исправлена в Windows Server версии 1709 и связанных инструментах RSAT.Для решения проблемы более низкого уровня обратитесь в службу поддержки Майкрософт и запросите обновление резервного копирования. Нет никакого обходного пути.
Ошибка «Не удалось найти указанный том» при запуске Test-SRTopology между двумя кластерами
При запуске Test-SRTopology между двумя кластерами и их путями CSV происходит сбой с ошибкой:
PS C: \> Test-SRTopology -SourceComputerName RRN44-14-09 -SourceVolumeName C: \ ClusterStorage \ Volume1 -SourceLogVolumeName L: -DestinationComputerName RRN44-14-13 -DestinationVolumeName C: \ ClusterStogon -DestinationNameC: \ ClusterStorageName \ VolumeName1 30 -ResultPath c: \ report
Test-SRTopology: указанный том C: \ ClusterStorage \ Volume1 не может быть найден на компьютере RRN44-14-09.Если это узел кластера, том должен быть частью роли или CSV; тома в доступном хранилище недоступны
В строке: 1 символ: 1
+ Test-SRTopology -SourceComputerName RRN44-14-09 -SourceVolumeName C: \ ...
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: ObjectNotFound: (:) [Test-SRTopology], исключение
+ FullyQualifiedErrorId: TestSRTopologyFailure, Microsoft.FileServices.SR.Powershell.TestSRTopologyCommand
При указании исходного узла CSV в качестве исходного тома необходимо выбрать узел, которому принадлежит CSV.Вы можете переместить CSV в указанный узел или изменить имя узла, указанное в -SourceComputerName . Эта ошибка получила улучшенное сообщение в Windows Server 2019.
Невозможно получить доступ к диску с данными в реплике хранилища после неожиданной перезагрузки при включенном BitLocker
Если BitLocker включен на обоих дисках (диск журнала и диск данных) и на обоих дисках реплики хранилища, при перезагрузке основного сервера вы не сможете получить доступ к основному диску даже после разблокировки диска журнала из BitLocker.
Это ожидаемое поведение. Чтобы восстановить данные или получить доступ к диску, вам необходимо сначала разблокировать диск с журналом, а затем открыть Diskmgmt.msc, чтобы найти диск с данными. Выключите диск с данными и снова подключите к сети. Найдите значок BitLocker на диске и разблокируйте диск.
Проблема с разблокировкой диска с данными на вторичном сервере после разрыва партнерства с репликой хранилища
После отключения SR-партнерства и удаления реплики хранилища ожидается, что вы не сможете разблокировать диск данных вторичного сервера с его соответствующим паролем или ключом.
Вам необходимо использовать ключ или пароль диска данных первичного сервера, чтобы разблокировать диск данных вторичного сервера.
Test Failover не монтируется при использовании асинхронной репликации
При запуске Mount-SRDestination для перевода целевого тома в оперативный режим в рамках функции Test Failover происходит сбой с ошибкой:
Mount-SRDestination: невозможно смонтировать группу SR <ТЕСТ>, подробная причина: группа или ресурс не в правильном состоянии для выполнения поддерживаемой операции.В строке: 1 символ: 1
+ Mount-SRDestination -ComputerName SRV1 -Name TEST -TemporaryP. . .
+ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~~~~~
+ CategoryInfo: NotSpecified: (MSFT WvrAdminTasks: root / Microsoft / ... (MSFT WvrAdminTasks: root / Microsoft /. T_WvrAdminTasks) (Mount-SRDestination], CimException
+ FullyQua1ifiedErrorId: системная ошибка Windows 5823, Mount-SRDestination.
При использовании синхронного типа партнерства тестовое аварийное переключение работает нормально.
Это вызвано известным дефектом кода в Windows Server версии 1709. Для решения этой проблемы установите обновление от 18 октября 2018 г. Эта проблема отсутствует в Windows Server 2019 и Windows Server версии 1809 и новее.
Дополнительные ссылки
Динамический транскриптом, доступный геном и профили цистрома PGR в миометрии человека
Введение
Миометрий – мышечный компонент матки, состоящий в основном из гладких мышц и сосудистых клеток.Основная функция миометрия – поддерживать структурную целостность матки во время беременности и обеспечивать силу сокращения во время родов. Гладкомышечные клетки миометрия увеличиваются в количестве и в размере, а также переходят от синтетического состояния к сократительному во время беременности [1, 2]. Эти клетки должны оставаться в состоянии покоя перед родами и производить фазовые сокращения на стадии родов [3]. После родов процесс инволюции уменьшает размер матки до небеременного состояния [4, 5].Заболевания, связанные с миометрием, могут привести к преждевременным родам, дистоции, аденомиозу и лейомиоме, которые являются серьезным бременем для здоровья матери и ребенка.
Стероидные гормоны прогестерон, эстроген и глюкокортикоид были показаны для регуляции экспрессии генов и пролиферации клеток гладкой мускулатуры миометрия [6–10]. Эстроген модулирует гены, связанные с сокращением, и индуцирует гиперплазию гладкомышечных клеток миометрия на ранних сроках беременности, активируя путь PI3K / mTOR и подавляя экспрессию миостатина [7, 8, 11, 12].Эстроген также поддерживает рост клеток-предшественников миометрия [13] и работает вместе с прогестероном, способствуя пролиферации клеток боковой популяции лейомиомы посредством регуляции паракринной передачи сигналов WNT от зрелых клеток миометрия. [14]. С другой стороны, передача сигналов прогестерона подавляет экспрессию генов, которые связаны с пролиферацией клеток в культивируемых клетках миометрия человека, и оказывает негативное влияние на пролиферацию гладких мышц сосудов [9, 15, 16]. Напротив, глюкокортикоиды подавляют пролиферацию клеток лейомиомы матки, клеток гладких мышц сосудов и клеток гладких мышц дыхательных путей, но не влияют на развитие клеточного цикла в культивируемых клетках гладких мышц матки [6, 17, 18].Роль прогестерона и глюкокортикоидов в миометрии на ранних сроках беременности остается неизвестной.
Прогестерон также является одобренным FDA токолитическим средством для предотвращения преждевременных родов [19]. Передача сигналов прогестерона в первую очередь опосредуется рецептором прогестерона (PGR) и чувствительна к эндокринным разрушителям окружающей среды [16, 20]. Механизмы, которые контролируют передачу сигналов прогестерона, включают метаболизм прогестерона, регуляцию транскрипции и посттрансляционные модификации PGR, а также взаимодействие между PGR и корегуляторами [21-25].Перед родами передача сигналов прогестерона миометрия подавляет воспалительную и сократительную активности через путь ZEB1 / ZEB2-miR-200-STAT5b, PGR-AP-1, содержащий репрессивный комплекс транскрипции и зависимую от цАМФ-DUSP1 регуляцию фосфорилирования PGR [23, 26, 27] . При переходе к стадии родов, появляющиеся сообщения предполагают, что повышенное соотношение изоформы A PGR в стихе B может изменить действие передачи сигналов прогестерона с репрессивного на индуктивное на транскрипцию генов родов, таких как GJA1, и дополнительно способствует соединению щелевых соединений в миометрии [ 27–29].Эти данные демонстрируют универсальность передачи сигналов прогестерона в биологии миометрия, проявляющуюся в активности его родственного рецептора PGR.
Это исследование фокусируется на физиологических изменениях между миометрием небеременных и доношенных беременных. Профили транскриптома, открытых участков хроматина и цистрома PGR в образцах миометрия человека на обеих стадиях документируются для выявления генетических путей и потенциальных основных механизмов, которые могут быть ответственны за структурную и функциональную адаптацию к беременности.Общие и отличные молекулярные особенности миометрия на этих двух стадиях не только обеспечивают клиническую значимость известных путей, но также предполагают новые механизмы, которые могут способствовать ремоделированию миометрия в поддержку беременности.
Материалы и методы
Образцы миометрия человека
Разрешение на работу с образцами тканей человека для всех экспериментов было получено от Институционального наблюдательного совета Медицинского колледжа Бейлора (BCM H-22119, утверждено 07.05.2008).Все образцы были получены из Гинекологического хранилища тканей для BCM, которому ранее было предоставлено разрешение на регулярный сбор образцов тканей женских половых путей в соответствии с отдельным протоколом IRB (H-33461). Письменное информированное согласие доступно для всех образцов, используемых для выполнения описанной работы.
Для целей этих экспериментов образцы миометрия были взяты у не рожающих беременных доношенных (TP; расчетный срок гестации 38-42 недели), перенесших кесарево сечение по обычным клиническим показаниям.Все образцы миометрия беременных женщин были взяты с краев гистеротомии после родов. Образцы не собирались у женщин, у которых в течение 6 часов после операции было увеличено количество родов, вызванных питоцином, или у женщин, ранее получавших 17-гидроксипрогестерон для лечения преждевременных родов. Кроме того, не собирались образцы у женщин, беременность которых осложнялась другими заболеваниями (включая, помимо прочего, гестационный диабет> IB, хориоамнионит, гипертензию, вызванную беременностью, преэклампсию, HELLP-синдром или его варианты).Образцы негравидного миометрия (НП) были получены от здоровых женщин в пременопаузе, перенесших обычную клинически показанную гинекологическую операцию. Все образцы негравидного миометрия были взяты из здорового миометрия в пролиферативную фазу менструального цикла и из участков, которые исключали как серозную оболочку матки, так и эндометрий, и находились на расстоянии не менее 2 см от ближайшей лейомиомы. Любые образцы от женщин, принимавших прогестины до операции, были исключены из анализа.
После кратковременной промывки каждого образца в фосфатно-солевом буфере (PBS) кусочки миометрия либо мгновенно замораживали (ChIPSeq), либо сохраняли, погружая их в ледяной RNAlater (RNASeq) с временем теплой ишемии менее 30 минут.Впоследствии все образцы хранили при температуре <-80 ° C до использования. Анализы для каждого отдельного образца перечислены в таблице S1.
Экстракция РНК
Образцы миометрия гомогенизировали с помощью гомогенизатора bead Mill 24 (15-340-163, Fisher Scientific, Waltham, MA) в пробирках Bead Mill Tubes (15-340-154 Fisher Scientific, Waltham, MA) с 1 мл Trizol (15596026, Thermo Fisher Scientific, Уолтем, Массачусетс). Тканевые остатки осаждали и удаляли центрифугированием при 12000 g в течение 10 минут при 4 ° C. После добавления 200 мкл 1-бром-3-хлорпропана образцы вручную встряхивали в течение 20 секунд с последующей инкубацией при комнатной температуре в течение 3 минут.Разделение фаз проводили центрифугированием при 12000 g в течение 18 минут при 4 ° C. РНК-содержащий водный слой сохраняли и затем смешивали с 500 мкл этанола крепостью 200 мкл. Затем смесь пропускали через колонку для связывания РНК в RNeasy Mini Kit (74104, Qiagen, Germantown, MD) с последующими этапами промывки и элюирования, описанными в руководстве производителя.
RNAseq
Три образца миометрия NP и три TP подвергали анализу RNAseq. Библиотеки, приготовленные из образцов миометрия, секвенировали примерно с 50 миллионами считываний парных концов 101 пар оснований на образец.Необработанные чтения были впоследствии обработаны фильтрацией со средним показателем качества выше 20. Затем чтения были согласованы с hg19 с использованием TopHat версии 2.0.4 [30]. Значения экспрессии RNAseq выражали в виде значений FPKM (количество фрагментов на килобазу экзона на миллион фрагментов). Дифференциальное выражение было рассчитано с использованием Cufflink версии 2.2.1 [31]. Дифференциально экспрессируемые гены определяются как абсолютное кратное изменение ≥ 1,4, скорректированное значение p <0,05 и наличие FPKM ≥ 1 по крайней мере в одном из образцов.Функциональный анализ списков генов был выполнен с использованием анализа пути изобретательности (IPA, www.ingenuity.com) и базы данных для аннотаций, визуализации и интегрированного обнаружения (DAVID) v6.8 [32, 33].
ATACseq
Три образца миометрия от небеременных (NP) и трех доношенных (TP) образцов миометрия были отправлены в Active Motif (Карлсбад, Калифорния) для службы подготовки библиотеки (каталожный номер 25079). Библиотеки были созданы с помощью набора для подготовки библиотеки ДНК Illumina Nextera и секвенированы с помощью Active Motif и ядра для секвенирования NIEHS с помощью систем Illumina HiSeq 2000 и NextSeq 500 с считыванием парных концов 42 п.н. на каждом образце.Необработанные чтения были первоначально обработаны адаптерами обрезки и фильтрацией со средним показателем качества выше 20. Чтения, прошедшие начальную обработку, были согласованы с эталонным геномом человека (hg19) с использованием версии 1.1.2 Bowtie [34]. После удаления считываний, сопоставленных с митохондриальной ДНК, однозначно сопоставленные дедуплицированные считывания в каждом образце были нормализованы понижающей дискретизацией до 91,5 млн отдельных считываний. Для последующего анализа использовались только первые 9 пар оснований каждого считывания. Области открытого хроматина (OCR) были впервые идентифицированы с помощью MACS2 [35] с отсечкой скорректированного p-значения 0.0001, с последующим объединением геномных интервалов в пределах 100 пар оснований друг от друга.
Анализ мотивов и аннотация пиков к соседнему гену в пределах 25 КБ были выполнены с помощью инструмента обнаружения мотивов гипергеометрической оптимизации Motif EnRichment (HOMER) [36]. Алгоритм двумерного геномного следа (BaGFoot) [37] был использован для идентификации связывающих мотивов, демонстрирующих изменение доступности хроматина, включая глубину отпечатка и доступность фланкирования между двумя стадиями миометрия с настройками по умолчанию.
ChIPseq
Два образца миометрия NP и два образца TP подвергались анализу ChIPseq.Иммунопреципитация хроматина, подготовка библиотеки и секвенирование выполняли с помощью Active Motif (номер по каталогу 25006 и 25046, Карлсбад, Калифорния) с использованием антитела против PGR (sc-7208, Santa Cruz Biotechnology, Даллас, Техас) и пользовательской библиотеки Illumina со стандартом Адаптеры Illumina PE [38]. Система Illumina HiSeq 2000 использовалась для секвенирования следующего поколения. Идентифицированные считывания односторонних последовательностей длиной 50 нуклеотидов были сопоставлены с геномной сборкой hg19 с использованием Bowtie версии 1.1.2 с настройками по умолчанию.В последующем анализе использовались только те считывания, которые прошли фильтр чистоты Illumina и имеют средний балл качества 20 или выше, выровнены не более чем с 2 несовпадениями и однозначно сопоставлены с геномом. Кроме того, если не указано иное, повторяющиеся чтения были удалены с помощью инструмента MarkDuplicates, доступного в picard-tools-1.119. Сохраненные выравнивания чтения были отсортированы по координатам, расширены до 300 баз, а затем случайным образом уменьшены до 9 миллионов интервалов на выборку с помощью пользовательских сценариев. MACS (версия 2.1.1.20160309) был использован для выполнения пикового вызова с отсечкой FDR на 0,0001, используя вход миометрия человека в качестве контроля. Функции HOMER «annotatePeaks.pl» и findMotifsGenome.pl с настройками по умолчанию использовались для аннотации пиков и анализа обогащения мотивов заданных диапазонов пиков [36]. BEDTools версии 2.27.1 был выбран для слияния и пересечения пиков в анализе перекрытия с настройками по умолчанию [39].
ChIP-qPCR
Два образца NP и два образца TP, независимо от образцов, используемых в ChIPseq, были подвергнуты анализу ChIP-qPCR.ChIP-qPCR выполняли с помощью Active Motif (Карлсбад, Калифорния) с использованием антитела против PGR (sc-7208, Santa Cruz Biotechnology, Даллас, Техас). Последовательности праймеров для анализа ЧИП-КПЦР являются ENO1_cF: AGCCCTTCCCCAATCATTAC, ENO1_cR: TACGTTCACCTCGGTGTCTG, LDHA_cF: GTGCATTCCCGGTACGGTAG, LDHA_cR: AGCAGAACCAGAGGCAGTTG, PLCL1_cF: GGAGAATGCGGGTCATCTTG, PLCL1_cR: CAGGAAACAAGCAGGAGTAGG и Untr12 (каталог # 71001, Активный Motif, Карлсбад, Калифорния). События связывания PGR рассчитывали в соответствии с уравнением, опубликованным в руководстве пользователя по каталожному номеру Active Motif 12970399.
Количественная ОТ-ПЦР
Шесть образцов NP и девять образцов TP, независимо от образцов, используемых в RNAseq, были подвергнуты количественному анализу ОТ-ПЦР. кДНК получали с помощью набора Transcriptor First Strand cDNA Synthesis Kit (043701, Roche Life Science, Penzberg, Germany) в соответствии с руководством производителя. ПЦР проводили с использованием SsoAdvanced Universal SYBR Green Supermix (1725270, Bio-Rad, Hercules, CA) или SsoAdvanced Universal Probes Supermix (1725280, Bio-Rad, Hercules, CA) на системе обнаружения ПЦР в реальном времени CFX Connect (1855201, Bio-Rad, Hercules, CA) согласно инструкции производителя.
праймеры, используемые в настоящем исследовании, включают OXTR_F: GGGGAGTCAACTTTAGGTTCG, OXTR_R: TTCCTCGGGATGTTCAGC, GJA1_F: GCCTGAACTTGCCTTTTCAT, GJA1_R: CTCCAGTCACCCATGTTGC, ZEB1_F: CCTAAAAGAGCACTTAAGAATTCACAG, ZEB1_R: CATTTCTTACTGCTTATGTGTGAGC, PLCL1_F: CAGGAAAAGATTGTACAGTGTCAGA, PLCL1_R: TTTGCCCCCAAATTATGAAG, SLC2A1_F: GGTTGTGCCATACTCATGACC, SLC2A1_R: CAGATAGGACATCCAGGGTAGC, HK2_F: GCTGAAGGAAGCGATCCA, HK2_R: GTGTCGTTCACCACAGCAAC, ALDOB_F: GGCAAGGCTGCAAACAAG, ALDOB_R: CCCGTGTGAACATACTGTCCT, PGK1_F: CAGCTGCTGGGTCTGTCAT, PGK1_R: GCTGGCTCGGCTTTAACC, ENO1_F: TCCCAACATCCTGGAGAATAA, ENO1_R: ATGCCGATGACCACCTTATC, PKM2_F: ACGTGGATGATGGGCTTATT, PKM2_R: CCAAGGAGCCACCATTTTC, LDHA_F: GTCCTTGGGGAACATGGAG и LDHA_R: TTCAGAGAGACACCAGCAACA.Зонд 18S рРНК предоставлен ThermoFisher Scientific (4319413E, ThermoFisher Scientific, Waltham, MA). Все результаты ОТ-ПЦР были нормализованы к уровням экспрессии 18S рРНК внутреннего контроля.
Статистический анализ
Двусторонний t-критерий Стьюдента с равной дисперсией использовался для количественных анализов qPCR.
Депозит данных высокого содержания
Необработанные данные RNAseq, ChIPseq и ATACseq находятся под SuperSeries GSE137552 в Омнибусе экспрессии генов Национального центра биотехнологической информации Национальной медицинской библиотеки.
Результат
Адаптивный транскриптом миометрия для беременности
Предыдущие исследования показали, что экспрессия генов, связанных с родами, OXTR и GJA1 увеличивается, а ZEB1 и PLCL1 снижают экспрессию при переходе от состояния покоя к родам. миометрий беременной [40–43]. Однако уровни экспрессии этих генов в миометрии до родов остаются неясными. После изучения 6 образцов миометрия у небеременных (NP) и 9 доношенных (TP) мы расширили эти результаты, продемонстрировав, что уровни мРНК генов OXTR, GJA1, ZEB1 и PLCL1 начинаются ниже в миометрии небеременных и повышаются к сроку беременности. беременность (рисунок 1).Эти наблюдения предполагают, что транскриптом миометрия динамически находится между двумя состояниями миометрия при подготовке к родам.
Рисунок 1. Уровни мРНК родственных родов генов в миометрии небеременных и доношенных беременных.Относительные уровни мРНК с помощью qRT-PCR в тканях миометрия 6 (NP, точки) и 9 (TP, треугольники) людей. Ось Y обозначает относительные уровни мРНК. *, p <0,05 по двустороннему t-критерию. Оранжевые полосы обозначают среднее значение для каждой группы.
Полногеномная динамика транскриптома от стадии NP к стадии TP была дополнительно исследована с помощью RNAseq в когорте образцов миометрия, независимо от тех, что в вышеупомянутом исследовании маркерных генов (Таблица S1).Используя критерий среднего количества фрагментов на килобазу транскрипта на миллион картированных прочтений (FPKM), большее или равное 1, по крайней мере, в одном из шести образцов, в миометрии было обнаружено 15907 активных генов (Таблица S2). В каждой группе NP и TP миометрий каждый имеет 14899 и 15260 активных генов, соответственно (Таблица 1 и Таблица S2). Между этими двумя стадиями образцы NP и TP разделяют 14612 активных генов (Таблица S2). В то время как 95,7% генов, экспрессирующих NP и 93,4% TP, присутствуют на обеих стадиях (таблица 1), общие профили транскриптомов демонстрируют значительную разницу, о чем свидетельствует анализ основных компонентов, который показывает четкое разделение между образцами стадий TP и NP (рисунок 2A).Эти данные предполагают, что зависимая от беременности динамика транскриптома в миометрии в первую очередь является результатом изменения уровней мРНК, а не состава экспрессирующих генов.
Рис. 2. Различия между тканями миометрия NP и TP на транскриптомном уровне.(A) Анализ основных компонентов транскриптомов NP (синий) и TP (красный). (B) Дифференциально экспрессируемые гены (DEG) между группами. Дифференциально экспрессируемые гены определяются как абсолютное кратное изменение ≥ 1,4, скорректированное значение p <0.05 и имеющий FPKM ≥ 1 хотя бы в одном из образцов.
Таблица 1.Транскриптом человеческого миометрия у небеременных (NP) и доношенных (TP) человеческих субъектов. Гены с FPKM ≥ 1 по крайней мере в одном из образцов в каждой группе определяются как выраженные.
Используя абсолютное кратное изменение больше или равное 1,4 и скорректированное значение p меньше 0,05 в качестве отсечки, между двумя стадиями миометрия было идентифицировано 2890 дифференциально экспрессируемых генов (DEG) с относительно более высокой экспрессией 1043 и 1847 генов. в тканях NP и TP, соответственно (рис. 2B).Гены, связанные с родами, снова демонстрируют повышенную экспрессию к доношенной беременности в этой когорте образцов со средними кратными изменениями: 156 для OXTR , 2,9 для GJA1 , 1,6 для ZEB1 и 2,6 для PLCL1 (Таблица S2), что соответствует предыдущие наблюдения в другой когорте особей (рис. 1). Анализ онтологии генов на DEG показывает, что гены, экспрессируемые на более высоких уровнях на стадии NP, обогащены в терминах, связанных, среди прочего, с транскрипцией, связыванием РНК и активностью гистондеацетилазы, что отражает синтетическое состояние миометрия NP.Напротив, термины, связанные с врожденным иммунитетом, транспортом и метаболизмом протеаз и углеводов, чрезмерно представлены среди генов с более высокими уровнями экспрессии во время беременности (Таблица 2 и Таблица S3), демонстрируя молекулярный профиль сократительного состояния в пользу контроля воспаления, внеклеточного ремоделирование и повышенная потребность в энергии, а также подготовка к последующим родам. Дальнейшее изучение 2890o выявляет потенциальные изменения молекулярной активности между стадиями NP и TP, что предсказывается дифференциальной экспрессией нижестоящих генов-мишеней интересующих молекул.Анализ пути изобретательности (IPA) оценивает повышенную активность TGFβ, PDGF, ERK и STAT, связанных с расширением / ремоделированием миометрия, TNF и AP-1, связанными с управлением воспалением, а также передачу сигналов p53, связанных с сокращением миометрия, среди прочего (Таблица 3 и Таблица S4 ) [11, 44–49]. Изменения этих молекулярных активностей, по-видимому, эволюционно законсервированы, о чем свидетельствует аналогичное наблюдение, в котором сравниваются транскриптомные профили миометрия мыши между 18,5 днями после коитуса и девственными (GSE17021, Таблица 3 и Таблица S5).Примечательно, что большинство подмножеств DEG, которые соответствуют IPA курируемой глюкозе ниже по течению, демонстрируют изменения экспрессии генов, согласующиеся с ответом на лечение глюкозой (таблица 3, таблица S4 и таблица S5), что предполагает относительно более высокую утилизацию глюкозы на стадии TP. Этот результат также согласуется с вышеупомянутым обнаружением обогащения онтологии генов, как показано в Таблице 2. Более того, гены, которые кодируют ферменты пути гликолиза, включая SLC2A1, ALDOB, PGK1, ENO1, PKM2 и LDHA , показали повышенную мРНК. уровни к доношенной беременности в двух независимых когортах образцов (рис. 3 и таблица S2).Ген HK2, который кодирует гексокиназу для фосфорилирования глюкозы, также показал значительно более высокие уровни экспрессии в миометрии TP в первой когорте, несмотря на то, что вместо этого продемонстрировал тенденцию к увеличению во второй когорте (рис. 3). Более высокая экспрессия генов гликолитического пути и нижестоящих мишеней глюкозы вместе предполагает увеличение использования глюкозы в миометрии TP по сравнению с таковым на стадии NP. Взятые вместе, эти результаты иллюстрируют адаптивный транскриптом миометрия в ответ на беременность и при подготовке к родам в различных аспектах, таких как реорганизация структуры, управление воспалением и сокращением, а также метаболическая адаптация.
Рисунок 3. Экспрессия гликолитических генов.На диаграмме слева изображен путь гликолиза. (A) Результаты RNAseq. Желтым и синим цветом показаны соответственно высокий и низкий уровни экспрессии генов. N = 3 для НП и 3 для ТП. (B-H) Относительные уровни мРНК в тканях из той же когорты людей, как показано на фиг.1. Ось Y обозначает относительные уровни мРНК. *, p <0,05 по двустороннему t-критерию. Оранжевые полосы обозначают среднее значение для каждой группы. N = 6 для НП и 9 для ТП.
Таблица 2.Онтология обогащенных генов включает в себя дифференциально экспрессируемые гены (DEG) между NP и TP миометрия.
Таблица 3.Изменения молекулярной активности от NP к TP, предсказанные с помощью анализа пути изобретательности (IPA) на основе результатов человеческого RNAseq и мышиных микрочипов (GSE17021, девственный миометрий против 18,5 dpc).
Динамика доступного генома в миометрии
Поскольку профили транскрипции миометрия адаптируются к беременности, мы затем исследуем доступность генома миометрия, чтобы проверить, различаются ли также профили открытых участков хроматина между состояниями NP и TP.Анализ доступного для транспозаз хроматина с использованием секвенирования (ATACseq) [50] проводили на образцах миометрия трех человек на каждой стадии. Каждый NP и TP миометрий имеет 45501 и 85777 открытых участков хроматина (OCR), идентифицированных по крайней мере в одном из трех образцов в группе (рисунок 4 и таблица S6). Среди этих областей генома 9564 (класс I) и 50840 (класс III) OCR присутствуют исключительно в состояниях NP и TP, соответственно, тогда как 35937 OCR (класс II) могут быть обнаружены в обоих состояниях (рисунок 4).В каждом классе OCR HOMER идентифицировал обогащение 128, 82 и 121 мотивов связывания транскрипционного фактора в OCR класса I, II и III, соответственно (Таблица S7). Среди этих обогащенных мотивов 45, 3 и 13 мотивов демонстрируют обогащение, уникально присутствующее в OCR класса I, II и III, соответственно (Таблица 4). Гены, которые кодируют соответствующие факторы транскрипции для подавляющего большинства этих мотивов, обнаружены активными в тканях миометрия человека (Таблица S2), подразумевая, что на взаимодействия этих факторов транскрипции с геномной ДНК с высокой вероятностью может повлиять изменение структуры хроматина между двумя состояниями. тканей миометрия.
Рисунок 4. Открытая область хроматина в миометрии.Число участков открытого хроматина (OCR), идентифицированных в 3 NP и 3 TP образцах с помощью ATACseq. OCR внутри каждой группы были объединены. Также отмечается количество общих и уникальных OCR между выборками NP и TP.
Таблица 4.Обогащенные мотивы в каждом классе участков открытого хроматина.
OCR класса I и III, которые расположены в пределах 25 т.п.н. от сайтов начала транскрипции DEG, произвольно определены как DEG-ассоциированные динамические OCR (таблица 5), что делает эти OCR потенциальными регуляторными элементами генов для связанных DEG, находящихся под контролем хроматина. структурные изменения.Среди связанных OCR и DEG положительная корреляция наблюдается между 2989 OCR и 1461 DEG, которые имеют повышенную экспрессию генов, сопутствующую повышенной доступности генома или пониженную экспрессию генов с пониженной доступностью генома (Таблица 5). Это наблюдение предполагает, что эти 2989 OCR могут функционировать как предполагаемые энхансеры для 1461 ассоциированных DEG. С другой стороны, отрицательная корреляция наблюдается между 1660 OCR и 980 DEG, которые демонстрируют снижение экспрессии генов с увеличением доступности генома или увеличение экспрессии генов с уменьшением доступности генома (Таблица 5).Эта обратная корреляция подразумевает роль этих 1660 OCR как предполагаемых репрессоров для 980 DEG. Анализ обогащения мотивов DEG-ассоциированных динамических OCR дополнительно выявляет кандидаты в регуляторы транскрипции, которые могут контролировать транскрипцию ассоциированных DEG и на действия которых, возможно, влияет изменение структуры хроматина между двумя состояниями миометрия (Таблица S8). Среди ДНК-связывающих белков, которые могут занимать эти обогащенные мотивы, рецептор эстрогена, рецептор глюкокортикоидов, рецептор прогестерона, факторы транскрипции MEF2C, NFAT, NFkB, AP-1 и STAT были изучены на предмет их роли в биологии миометрия [6, 51– 54]; а CTCF и YY1 известны своими функциями в регуляции конформации хроматина [55, 56].Присутствие этих мотивов в динамических OCRs предполагает, что изменения в структуре хроматина также могут оказывать влияние на действия этих регуляторов транскрипции и конформации хроматина в модуляции ассоциированных DEGs между двумя состояниями миометрия. Дальнейшее изучение связанных DEG с помощью анализа обогащения онтологии генов обнаружило сигнальные пути, которые потенциально подвержены структурным изменениям хроматина, включая GTPases семейства Rho, актиновый цитоскелет, щелевые соединения, eNOS, релаксин, PDGF и HIPPO передачу сигналов для ремоделирования миометрия и регуляции сокращения, а также гликолиз и адреномедуллин для контроля метаболизма и кровообращения (таблица 6 и таблица S9).Таким образом, эти находки идентифицируют потенциальные сигнальные пути и их предполагаемые регуляторы транскрипции в миометрии человека, которые могут иметь дополнительный механизм контроля через доступность генома.
Таблица 5. Связь между DEG и динамическими OCR.Области открытого хроматина I и III классов определяются как DEG-ассоциированные, если они расположены в пределах 25 т.п.н. от сайта начала транскрипции DEG. Положительная корреляция определяется, если 1. повышенная экспрессия гена и доступность генома в связанных областях открытого хроматина или 2.снижение экспрессии генов и доступность генома в связанных областях открытого хроматина. Отрицательная корреляция определяется, если: 1. сниженная экспрессия гена и повышенная доступность генома в связанных областях открытого хроматина или 2. повышенная экспрессия гена и пониженная доступность генома в связанных областях открытого хроматина. Все сравнения были сделаны TP над NP.
Таблица 6.Избранные пути, связанные с изменениями статуса открытого хроматина. Анализ канонических путей IPA.
Данные ATACseq также позволяют оценить следы факторов транскрипции в открытых областях хроматина.Алгоритм двумерного геномного следа (BaGFoot) позволяет идентифицировать мотивы, которые расположены в углубленных участках следа связывания с белком (Δfootprint depth) в открытых областях хроматина, увеличивая доступность ДНК (Δ-фланкирующую доступность) из одного состояния в другое [37]. Ткани миометрия NP и TP демонстрируют различные наборы обогащенных мотивов (Рисунок S1 и Таблица S10). Соответствующие факторы транскрипции, которые могут занимать эти мотивы и также экспрессируются ALX1, ARID3A, FOXC1, FOXJ2, FOXJ3, HLF, HMGA1, HOXA13, HOXA5, HOXD9, NFIL3, NKX3.1, PBX1, POU6F1, PRRX2, REL и TBP для миометрия TP. Напротив, экспрессирующие регуляторы транскрипции, которые могут связываться с обогащенными мотивами в миометрии NP, включают EGR1, MDB2, MECP2, NRF1, SP1, SP2, SP3, SP4, ZBTB7B, ZBTB4 и ZNF219. Наши данные предполагают, что взаимодействия между этими факторами транскрипции и их геномными сайтами-мишенями в миометрии, вероятно, подвержены изменению структуры хроматина на эпигеномном уровне, переходящем между двумя состояниями миометрия.
Занятость генома PGR в тканях миометрия
Поскольку PGR играет жизненно важную роль в передаче сигналов прогестерона, и обогащение его мотива ДНК обнаруживается в областях открытого хроматина миометрия, мы затем исследуем профили занятости генома PGR в обоих случаях. Этапы НП и ТП. Биопсии миометрия от двух отдельных людей на каждой стадии подвергались анализу PGR ChIP-seq. Выявление пиков с использованием данных внутри каждого отдельного образца определяет интервалы занятия 24095, 9778, 10717 и 8053 PGR в образцах миометрия NP1, NP2, TP1 и TP2, соответственно, после нормализации до той же глубины секвенирования при 9 миллионах считываний на образец (Таблица S11).Эти области связывания PGR, представленные на каждой стадии, составляют 48,3% и 15,0% областей открытого хроматина в миометрии NP и TP, соответственно. Занятие PGR обогащено промоторами и 5′-нетранслируемыми областями (UTR) во всех четырех образцах миометрия за счет дистальных межгенных областей (Таблица 7), что предполагает тесное взаимодействие между PGR и аппаратом транскрипции вокруг промоторов in vivo для регуляция экспрессии генов. Примечательно, что увеличение занятости миометрия PGR вокруг промотора наиболее заметно в небеременном состоянии (34.3% для NP1 и 35,4% для NP2). С другой стороны, такое обогащение относительно ниже в состоянии TP (26,4% для TP1 и 12,0% для TP2) со сравнительно более высоким процентом связывания PGR в дистальной межгенной области (таблица 7). Это открытие указывает на то, что перераспределение занятости генома PGR происходит одновременно с ремоделированием миометрия и транскриптомными изменениями при адаптации к беременности.
Таблица 7. Полногеномные PGR, занимающие сайты относительно генных тел. Интервалы связыванияPGR были аннотированы системой аннотаций цис-регуляторных элементов.Промотор определяется как область в пределах 3 т.п.н. выше сайта начала транскрипции. Под телом гена понимается интервал в пределах 3 т.п.н. ниже сайта терминации транскрипции.
Последовательности ДНК областей, занимающих PGR, продемонстрировали значительное обогащение консенсусного мотива связывания PGR [57] во всех четырех образцах миометрия по сравнению с фоновым геномом (обогащение p , значение 1 × 10 −18 [NP1], 1 × 10 −686 [NP2], 1 × 10 −1105 [TP1], 1 × 10 −1059 [TP2], таблица S12), в то время как мотив консенсуса PGR чаще встречается в TP чем интервалы связывания PGR миометрия NP (21.33% [TP1] и 26,20% [TP2] против 5,01% [NP1] и 18,57% [NP2], таблица S12). Избыточное представительство связывающих мотивов для факторов транскрипции, которые имеют известные признаки в миометрии, также наблюдается во всех образцах миометрия, включая NR3C1 (рецептор глюкокортикоидов) [6, 58], ATF3 [59], FOSL1 [60], JUN [60] , KLF9 [61, 62], NF k B [63, 64] и STAT5 [54] (Таблица S12). Точно так же ДНК-связывающие мотивы для кофактора PGR FOSL2 [27, 57], регулятора дифференцировки гладких мышц TCF21 [65] и главного регулятора гладких мышц SRF (CArG) [66, 67] также чрезмерно представлены во всех образцах ( Таблица S12).Эти данные в совокупности показывают, что PGR может взаимодействовать с ДНК посредством как зависимых от консенсусных мотивов, так и независимых способов, и такое взаимодействие является динамичным во время ремоделирования миометрия. Более того, наши наблюдений in vivo обеспечивают клиническую релевантность предыдущим находкам in vitro о том, что PGR взаимодействует с другими известными факторами транскрипции миометрия и мышц в непосредственной близости от цис-действующих элементов для регуляции транскриптома миометрия.
Дальнейшее изучение данных по обогащению мотивов идентифицирует кандидатные факторы транскрипции миометрия, связанные с PGR, однако их функции в миометрии ждут исследования.Белки TEAD, как известно, опосредуют путь Hippo для регуляции размера мышечных волокон [68] и взаимодействуют с факторами AP-1 для решения судьбы гладких мышц [69]. Мотив для факторов транскрипции TEAD чрезмерно представлен в интервалах связывания PGR во всех четырех образцах (таблица S12), а экспрессия TEAD1, TEAD2, TEAD3 и TEAD4 обнаруживается как в тканях миометрия NP, так и TP (таблица S2). Факторы транскрипции семейства BATF действуют как пионерный фактор, который контролирует доступность хроматина [70] и служат ко-регуляторами для PGR, NR3C1 и AP-1 [71–73].Связывающий мотив для BATF, членов суперсемейства AP-1, является одним из самых богатых мотивов в областях связывания PGR во всех четырех образцах миометрия (Таблица S12), а BATF, BATF2 и BATF3 все экспрессируются на обеих стадиях исследуемого миометрия ( Таблица S2). YY1, регулятор конформации хроматина и образования петель ДНК [56], обнаруживает адекватные уровни мРНК между стадиями NP и TP (Table S2). Интересно, что мотив связывания YY1 чрезмерно представлен вокруг сайтов связывания PGR образцов миометрия NP, но становится менее обогащенным по сравнению с фоном в образцах TP (обогащение p , значение 1 × 10 -55 [NP1], 1 × 10 −61 [NP2], 1 × 10 −20 [TP1],> 0.01 [TP2], таблица S12). Эти находки указывают на потенциальные взаимодействия PGR с сигнальным путем Hippo, воспалительным ответом и регуляторами конформации хроматина для контроля транскрипции in vivo . Более того, пример связанного со стадиями дифференциального обогащения мотива YY1 в интервалах связывания PGR предполагает, что PGR может работать с различными наборами факторов транскрипции, обеспечивая профили транскриптомов, специфичные для фенотипа.
Затем мы определяем общие и различные интервалы связывания PGR между образцами миометрия NP и TP.Пики связывания Union PGR в образцах были получены на основе всех интервалов связывания PGR в четырех образцах, чтобы задокументировать присутствие и отсутствие каждого сайта связывания PGR в отдельных образцах. Всего найдено 30613 пиков связывания объединенных PGR (фиг. 5 и таблица S13). Количество объединяющих пиков, присутствующих в каждом образце, составляет 24019, 9491, 10402 и 7928 для NP1, NP2, TP1 и TP3 соответственно (рис. 5). Ткани миометрия NP1 и NP2 имеют 7323 пика слияния, в то время как это число между TP1 и TP2 составляет 4839 (Рисунок 5).Среди этих 7323 пиков в миометрии NP, связывающие мотивы PGR, факторов транскрипции STAT, SRF, MyoD и SMAD2 чрезмерно представлены (Рисунок 6 и Таблица S14). Обогащение этими мотивами также обнаруживается среди 4839 сайтов, занимающих PGR в TP миометрии (Рисунок 6 и Таблица S14). В соответствии с результатами анализа мотивов на отдельных образцах (таблица S12), консенсусный мотив PGR демонстрирует более высокие уровни обогащения PGR, занимающим интервалы миометрия TP, по сравнению с таковым на стадии NP (фигура 6).Кроме того, мотивы STAT, MyoD и SMAD2 также демонстрируют повышенное обогащение в миометрии TP, в то время как мотив CArG имеет более сильное избыточное представительство в образцах NP (Рисунок 6 и Таблица S14). Эти наблюдения указывают на то, что регулировка партнерства с другими факторами транскрипции на разных стадиях является обычным процессом среди особей за пределами индивидуальных вариаций.
Рисунок 5. Количество областей, занимающих PGR в геноме миометрия человека.PGR ChIP-seq выполняли на двух отдельных образцах на стадиях NP или TP.Диаграмма Венна цветка показывает количество перекрывающихся и различных участков, занимающих PGR, среди четырех экземпляров.
Рисунок 6. Избранные обогащенные мотивы в общих интервалах связывания PGR на каждой стадии.Дальнейшее изучение связанных со стадией областей, занимающих PGR, выявило 2220 геномных областей, которые являются общими между 7323 и 4839 интервалами связывания PGR, в то время как 2773 и 1047 имеют отчетливое присутствие в NP и TP миометрии, соответственно (Рисунок 5). Помимо различий в геномных положениях, составы мотивов связывания транскрипционных факторов также демонстрируют расходящиеся профили среди этих трех групп областей, занимающих PGR (Таблица S15).Среди 95 мотивов, которые составлены из 50 верхних обогащенных мотивов каждой из трех групп, значения p обогащения выявляют существенное различие в степени представления этих мотивов между NP-отличными и TP-отличными регионами, занимающими PGR (рис. 7). Отдельные области TP сильно обогащены консенсусными связывающими мотивами для рецепторов прогестерона и глюкокортикоидов, белков AP-1 и факторов транскрипции TEAD, в отличие от относительно более низкого обогащения в отдельных областях NP.Напротив, отдельные сайты NP обнаруживают сильные сверхпредставления в мотивах факторов транскрипции ETS, фактора ядерной транскрипции Y, CTCF, YY1, Sp1 и NRF1, которые гораздо меньше обогащены отдельными участками TP. Примечательно, что 2220 общих областей имеют профиль обогащения мотивов, подобный профилю TP, а не отдельным областям NP (Рисунок 7). Это указывает на то, что PGR на стадии NP может взаимодействовать с более широким спектром регуляторов транскрипции, тогда как он, вероятно, работает с более сфокусированным набором факторов транскрипции в миометрии TP.В совокупности данные предполагают, что динамика мест связывания PGR между двумя состояниями миометрия позволяет различным комбинациям мотивов связывания факторов транскрипции, доступных для соответствующих регуляторов, взаимодействовать с PGR специфическим для состояния образом.
Фигура 7. Верхние обогащенные мотивы связывания факторов транскрипции в 2773 различных NPD (NPD), 1047 TP (TPD) и 2220 NP-TP общих (S) сайтах, занимающих PGR.Собираются 50 лучших мотивов из каждой группы и отображаются со значениями log p.Цветовые коды изображены в виде красно-бело-синего рисунка, при этом красный цвет указывает на наибольшее обогащение, а синий – на наименьшее обогащение.
Кандидаты в гены-мишени PGR, непосредственно расположенные ниже по течению в миометрии
Связь между занятостью генома PGR и транскриптомом миометрия оценивается путем идентификации генов, ближайших к 2220 общим и 2773 и 1047 различным интервалам связывания PGR между NP и TP миометрием. Среди этих 6040 областей, занимающих PGR, 4355 (72%) связаны с 2203 активными генами миометрия (Таблица 8 и Таблица S16).Эти 2203 гена-кандидата PGR, непосредственно расположенного ниже по течению, могут быть дополнительно разделены на 1431 NP-отличных, 183 TP-отличных и 589 NP-TP общих активных генов на основе их ассоциации с отдельными или общими интервалами связывания PGR (Таблица 8), в которых Анализ пути изобретательности идентифицировал 51, 37 и 166 канонических сигнальных путей, соответственно, которые имеют значение обогащения p менее 0,05 (Таблица S17). Профили 50 основных ассоциированных путей из каждой из трех групп проявляются в разных профилях (рис. 8).Известные примеры путей, которые селективно обогащены в отдельных группах, включают «передачу сигналов рецептора эстрогена» и «передачу сигналов метилирования ДНК и репрессии транскрипции» для отдельной группы NP, «передачу сигналов IL-10» и «ингибирование матричных металлопротеаз» для отдельной группы TP, и «передача сигналов актинового цитоскелета» и «передача сигналов р53» для общей группы NP-TP (рисунок 8 и таблица S17). Напротив, ни один канонический путь не имеет значения обогащения p менее 0,05 во всех трех группах.Эти данные предполагают, что каждая группа областей связывания PGR может вносить вклад в регуляцию когорты генов, которые обслуживают определенные функции физиологической адаптации во время беременности.
Рисунок 8. Верхние обогащенные канонические пути в 1431 NP-отличных (NPD), 183 TP-отличных (TPD) и 589 NP-TP общих (S), активных генах, связанных с PGR.Лучшие 50 обогащенных путей из анализа пути изобретательности из каждой группы компилируются и отображаются со значениями log p. Цветовые коды изображены в виде красно-бело-синего рисунка, при этом красный цвет указывает на наибольшее обогащение, а синий – на наименьшее обогащение.
Таблица 8.Связь между занятостью PGR и активными генами миометрия. Список ближайших генов к 2220, 7323 и 4839 общим и отличным интервалам занятия PGR был идентифицирован и дополнительно отфильтрован с критериями наличия максимального значения FPKM больше или равного 1 среди 6 образцов RNAseq миометрия для каталогизации активных PGR-ассоциированных гены.
Занятость PGR в областях генома в ассоциации с интересующими генами дополнительно исследуется на дополнительных образцах миометрия, по два каждого из стадий NP и TP (Таблица 9).Гликолитические гены ENO1 и LDHA демонстрируют уменьшенные события связывания в миометрии TP по сравнению с таковым в NP. Учитывая, что оба гена демонстрируют более высокие уровни экспрессии в образцах TP (Рисунок 3), эти данные вместе указывают на отрицательную корреляцию между занятостью PGR и уровнями мРНК. Функция PLCL1 ослабляет простагландин-зависимую передачу сигналов кальция (патент США 20160161487A1). PLCL1 экспрессируется в миометрии человека (Рисунок 3 и Таблица S2) [40] и является мишенью для PGR ниже по течению [74].Занятие PGR в области 93kb выше гена PLCL1 может быть обнаружено в обеих когортах образцов миометрия (таблица 9 и таблица S13), которая может служить функциональным регуляторным элементом для гена миометрия PLCL1 . Хотя были протестированы только несколько областей генома, воспроизводимое определение занятости PGR в различных когортах образцов миометрия подтверждает результаты ChIP-seq для всего генома. Более того, эти находки также идентифицировали кандидатные цис-действующие элементы, с помощью которых PGR может регулировать экспрессию гликолитических генов ENO1 и LDHA , а также связанного с сократимостью гена PLCL1 .
Таблица 9. ЗанятиеPGR в выбранных геномных локусах во второй когорте образцов миометрия. ChIP-qPCR выполняли в отдельном наборе тканей миометрия NP (n = 2) и TP (n = 2) для теста занятости PGR. Были выполнены технические трижды для каждой реакции qPCR, и среднее значение и стандартное отклонение трех повторностей были использованы для расчета событий связывания PGR. Untr12, расположенный в генной пустыне, служит отрицательным контролем.
Обсуждение
Новизна исследования
Настоящее исследование документирует молекулярный ландшафт NP и TP миометрия, а также изменения между этими двумя стадиями.В то время как предыдущие полногеномные исследования выявляют механизмы-кандидаты для перехода от состояния, не связанного с работой, к состоянию родов [40, 75, 76], представленные здесь результаты сообщают о том, как миометрий реорганизуется и адаптируется от небеременного к состоянию доношенной беременности. Это иллюстрируется равномерным увеличением мРНК генов, связанных с родом, OXTR, GJA1, ZEB1 и PLCL1 во время ремоделирования миометрия с последующим дивергентным изменением паттернов экспрессии (Рисунок 1). Примечательно, что уровни мРНК ZEB1 и PLCL1 миометрия снижаются от срока отсутствия работы до состояния срочных родов [40, 43], что контрастирует с нашими наблюдениями, что эти два гена демонстрируют увеличение экспрессии от небеременных к доношенным беременным. состояние (рисунок 1).На уровне всего генома 60 из 126 генов, у которых есть значительные изменения уровней мРНК между термином «нетрудоспособность» и «родовым состоянием», либо не показывают изменений (55 генов), либо имеют противоположное направление (5 генов) экспрессии в наших исследованиях [ 75]. Хотя это несоответствие может быть результатом расхождений в данных разных когорт людей, также возможно, что эти 60 генов могут находиться под жестким регулированием у небеременных, термин «нетрудоспособность» и термин «родовые состояния» для потенциальных функций, зависящих от стадии.Эти наблюдения оправдывают будущие исследования своевременного изменения транскриптома миометрия в нескольких состояниях для просмотра динамики экспрессии генов с высоким разрешением. В совокупности наши данные транскриптома расширяют спектр знаний о динамике экспрессии генов миометрия и закладывают основу для будущего метаанализа, чтобы понять генетическую программу ремоделирования миометрия между небеременным и доношенным состояниями. Выявленные здесь молекулярные пути также могут служить ориентиром для изучения генетических и экологических воздействий, которые подрывают нормальную беременность, приводя к таким заболеваниям, как преждевременные роды и дистоция.
Оцениваемые карты генома предлагают план для изучения генетической и эпигенетической регуляции транскриптома миометрия. Идентифицированные открытые области хроматина, вероятно, содержат цис-действующие элементы, которые участвуют в регуляции транскриптома миометрия, и они могут быть предметом эпигенетического контроля. Например, связывающие мотивы рецептора эстрогена и регулятора клеточного цикла E2F1 чрезмерно представлены в открытых областях хроматина, обнаруженных только в миометрии NP (Таблица 4), что отражает более высокие уровни экспрессии генов для транскрипции и контроля генов (Таблица 4). 2) и подразумевает подготовку пролиферации гладких мышц к расширению миометрия на ранних сроках беременности под контролем рецептора эстрогена.Другой пример – ген MEF2A, связанный с родами [51]. Обогащение связывающего мотива MEF2A в открытых областях хроматина класса III (Таблица 4) указывает на то, что доступность MEF2A к его сайтам-мишеням может быть другим уровнем регуляции его действия в дополнение к изменениям в уровнях экспрессии [51]. Наш полногеномный интегративный анализ доступности генома и транскриптома выявил потенциальные регуляторные элементы и связанные с ними молекулярные пути, которые могут влиять на доступность хроматина (таблица S8 и таблица S9).Эти данные открывают путь к дальнейшему углубленному изучению эпигенетического воздействия на изменения транскриптома миометрия.
Учитывая, что прогестерон является основным стероидным гормоном для беременности и имеет клинические показания для предотвращения преждевременных родов, сфокусированное исследование занятости миометрия PGR по всему геному предоставляет карту для выявления цис-действующих элементов, связанных с PGR, и их возможных нижестоящих генов-мишеней для дальнейшее исследование механизма действия PGR. Примечательно, что влияние потери маточного p53 на продолжительность беременности было описано на модели мышей [49].В нашем исследовании «передача сигналов p53» является одним из наиболее обогащенных путей в предполагаемых прямых последующих мишенях PGR (Таблица S17). Это открытие предполагает потенциальное взаимодействие между передачей сигналов PGR и p53 в миометрии. Между тем, чрезмерно представленные мотивы связывания факторов транскрипции, окружающие сайты, занимающие PGR, указывают на потенциальных партнеров, взаимодействующих с PGR для регуляции генов миометрия. Например, известно, что белки AP-1 являются партнерами PGR для регуляции генов, что подтверждается несколькими генами, производящими роды [27].Мы обнаружили, что связывающие мотивы многих субъединиц AP-1 являются одними из самых богатых мотивов в областях, занимающих PGR миометрия (Таблица S14 и Рисунок 7), что указывает на потенциальное общегеномное партнерство между PGR и AP-1. Наши результаты не только обеспечивают соответствие человека известным сигнальным путям на уровне in vivo , но также позволяют идентифицировать новые мишени, работающие с PGR или находящиеся под их контролем, для будущих исследований.
Показание рецептора прогестерона на метаболизм и ремоделирование миометрия
Повышенная экспрессия генов гликолитического пути и продукции лактата в образце миометрия доношенной беременной по сравнению с небеременным состоянием имеет два физиологических значения.Во-первых, это производство лактата и сократимость миометрия. Лактоацидоз миометрия наблюдается у женщин с дисфункциональными родами [77]. Было показано, что кислый pH отменяет сокращение миометрия [78]. Лечение лактатом может уменьшить спонтанные сокращения [79] и подавить воспаление матки и преждевременные роды [80]. Лактат превращается из продукта гликолиза пирувата в мышечной системе лактатдегидрогеназой. Снижение экспрессии в мышцах Ldha , кодирующей субъединицу лактатдегидрогеназы, приводит к снижению конверсии пирувата в лактат [81].Наши транскриптомные данные показывают, что путь гликолиза и продукции лактата настроен на увеличение способности обработки в терминальном состоянии по сравнению с таковым в небеременном миометрии (Рисунок 3 и Таблица S2). Более того, более высокая утилизация глюкозы миометрием в состоянии доношенной беременности также подтверждается изменением характера экспрессии генов, чувствительных к глюкозе (Таблица S4 и Таблица S5). Наши результаты показывают, что транскриптом миометрия приспосабливается к увеличению способности продуцировать лактат, что способствует поддержанию покоя миометрия.Второе замечание касается энергетического обмена и молекулярного биосинтеза. Наши транскриптомные данные показывают, что в миометрии TP увеличение молекулярной активности HIF1A, вероятно, происходит на основе характера экспрессии нижестоящих мишеней HIF1A (Таблица S4 и Таблица S5). Повышение активности HIF1A предполагает наличие гипоксического миометрия в срок. В анаэробных условиях повышенный гликолиз может генерировать АТФ, чтобы компенсировать потребность в энергии для поддержания клеточных функций. С другой стороны, при нормоксии повышенная способность к более высокому потоку гликолиза может поставлять промежуточные продукты для синтеза аминокислот, чтобы генерировать строительные блоки для расширения миометрия.Повышенная экспрессия гликолитического гена в ответ на беременность соответствует этим гипотезам об изменении функций миометрия (рис. 3). Наконец, связывание PGR в геномных локусах ENO1 и LDHA связывает PGR с регуляцией метаболизма миометрия (Таблица 9), что требует дальнейших исследований.
Ограничения и будущее направление
Разрешение данных молекулярного профилирования, интеграция мультиомической информации и небольшой размер выборки в анализах ChIPseq, RNAseq и ATACseq являются основными ограничениями для настоящего исследования.Данные по всему геному здесь представляют собой сводное наблюдение за многими клетками, которые находятся в частях тканей миометрия. Хотя гладкомышечные клетки составляют большую часть массы, показания других типов клеток, таких как клетки крови и сосудов, также включаются как часть сводных результатов, что может снизить отношение сигнал / шум информации о клетке. тип интереса. Несмотря на потенциальный вклад транскриптов других типов клеток, данные транскриптома миометрия демонстрируют сильную связь с известными программами гладких мышц и миометрия (таблица 2 и таблица 3), данные ATACseq устанавливают тесную связь между предполагаемыми цис-действующими элементами и сигнальными путями для мышечных функций. (Таблица 6), а данные цистрома PGR обнаруживают обогащение мотивов связывания для главных регуляторов гладких мышц SRF и MyoD (Рисунок 6).Эти примеры демонстрируют, что текущие данные могут предоставить важную информацию в поддержку существующих знаний и предоставить новые результаты. Новые методы молекулярного профилирования на уровне отдельных клеток обеспечат более высокое разрешение, чем текущие результаты, полученные с помощью более устоявшихся технологий, что приведет к дальнейшему изучению роли каждой клетки и лежащих в основе молекулярных событий в данном состоянии миометрия.
Еще одним ограничением разрешения данных является то, что антитело, используемое для генерации текущих результатов PGR ChIPseq, выявляет обе основные изоформы PGR в миометрии, PGR-A и PGR-B.Эти две изоформы PGR отличаются доменом трансактивации AF-3, который существует только в PGR-B. Обе изоформы функционально способны модулировать транскрипцию общих и различных наборов нижестоящих генов в зависимости от контекста [25]. Следовательно, стехиометрическое соотношение между двумя изоформами на разных стадиях миометрия необходимо учитывать при интерпретации влияния PGR на экспрессию связанных генов. Для исследований тканей человека существует острая необходимость в разработке специфичных для изоформ антител к PGR, возможно, посредством нацеливания на белковые домены с конформациями, специфичными для изоформ.
Что касается ограничения на интеграцию мультиомической информации, в этой рукописи исследование занятости PGR и ассоциации транскриптома миометрия основано на строгом критерии, который связывает только один ближайший ген с каждым отдельным сайтом, занимающим PGR (Таблица 8). Обоснование использования такого строгого критерия основано на наблюдении, что большинство сайтов, занимающих PGR, расположены рядом с телами генов (Таблица 7). Цис-действующие элементы, оккупированные PGR, вероятно, оказывают большее влияние на транскриптом миометрия в соответствии с появляющимися моделями контроля транскрипции, согласно которым каждый ген подлежит регуляции множественными энхансерами и наоборот в топологически ассоциированном домене, образованном посредством конформации хроматина [82, 83].Будущая интеграция данных о конформации хроматина, полученных с помощью высокопроизводительного анализа конформации хроматина, позволит лучше назначить связывающие PGR цис-действующие элементы с ассоциированными генами, особенно в отношении взаимодействий на больших расстояниях, чтобы обеспечить корреляционную информацию, более близкую к истинным молекулярным событиям.
Небольшой размер выборки по ATACseq и PGR ChIPseq, отчасти, также является ограничением настоящего исследования. Размер образцов биопсии и необходимое количество тканей для химического состава этих анализов сильно влияет на размер образца для исследования, особенно для анализов ATACseq и ChIPseq.Более того, содержание и текстура мышечной ткани создают проблемы для современной химии иммунопреципитации хроматина для ChIPseq и подготовки библиотеки для ATACseq. Эти факторы вместе препятствуют нашей способности исследовать образцы в более крупной когорте в масштабе всего генома. Появление новых технологий, включая CUT & Tag, протоколы с низким уровнем ввода клеток для ChIPseq и ATACseq, а также использование изолированных ядер из замороженных тканей в качестве контейнеров с химическими веществами может преодолеть некоторые технические препятствия и позволить в будущем проводить исследования на более крупных когортах образцов [84, 85].
Наши данные документируют молекулярные профили на двух концах физиологического спектра тканей миометрия. Помимо различных функциональных и структурных состояний, небеременные образцы находились в среде с низким уровнем прогестерона в сыворотке, в то время как образцы доношенных беременных подвергались воздействию высоких уровней прогестерона в сыворотке. Следовательно, при интерпретации молекулярных изменений между небеременным миометрием в пролиферативной фазе менструального цикла и миометрием беременной необходимо учитывать смешивающие факторы физиологического состояния мышечных тканей и дифференциальных уровней сывороточного прогестерона.Тем не менее, наши результаты предоставляют исходную информацию, которая может быть интегрирована с наблюдениями на моделях ex vivo культур эксплантатов или in vitro клеточных культур, чтобы выявить основные механизмы, которые регулируют ремоделирование миометрия. Большие различия в молекулярных профилях между этими двумя состояниями также предполагают, что будущие исследования тканей миометрия на стадиях, предшествующих сроку беременности, могут обеспечить лучшее разрешение зависимой от беременности молекулярной динамики миометрия, если образцы могут быть получены в достаточном количестве. для экспериментов.
Дополнительная информация
Обозначения дополнительных рисунков и таблиц
Рисунок S1.Мешок-график, отображающий изменение доступности ДНК (ΔFA) и изменение глубины следа связывания с белком (ΔFPD) от NP к этапам TP. Мотивы, имеющие статистическую значимость, отмечены красными квадратами.
Таблица S1. Список образцов миометрия человека.
Таблица S2. Активные гены в миометрии человека
Таблица S3. Полный список анализа генной онтологии в таблице 2.
Таблица S4. Прогнозируемая молекулярная активность с помощью анализа пути изобретательности. Гены, экспрессирующиеся по-разному, в миометрии человека NP и TP.
Таблица S5. Прогнозируемая молекулярная активность с помощью анализа пути изобретательности на дифференциально экспрессируемых генах между 18,5 dpc и миометрием девственной мыши (GSE17021).
Таблица S6. Координаты генома участков открытого хроматина в образцах миометрия человека.«1» и «0» обозначают присутствие и отсутствие соответственно в миометрии NP и TP. Классы определены на рисунке 4.
Таблица S7. Анализ обогащения мотивов с помощью известного мотива HOMER в трех классах областей открытого хроматина, которые определены на фиг. 4.
Таблица S8. Анализ обогащения мотивов на динамических OCR, связанных с DEG.
Таблица S9. канонических путей, которые связаны с динамическими OCR, связанными с DEG.
Таблица S10. Оценка транскрипционного следа в образцах миометрия NP и TP с помощью BaGFoot.
Таблица S11. Координаты генома (Hg19) PGR, занимающие интервалы в тканях миометрия четырех человек.
Таблица S12. Обогащенные мотивы в каждом отдельном образце миометрия. Данные взяты из выходных файлов алгоритма поиска неизвестных мотивов HOMER.
Таблица S13. Union пик информации об интервалах связывания PGR во всех четырех образцах миометрия.В разделе «UnionPeak-vs-Sample» 1 и 0 обозначают наличие и отсутствие пика связывания PGR в каждом отдельном образце.
Таблица S14. Обогащенный анализ 428 мотивов связывания факторов транскрипции в общих сайтах PGR, занимающих сайты на каждой стадии образцов миометрия.
Таблица S15. Обогащающий анализ 428 известных мотивов связывания факторов транскрипции в общих и различных областях, занимающих PGR, между группами NP и TP.
Таблица S16. Связь между занятостью PGR и активными генами миометрия.
Таблица S17. Канонические пути в связи с занятостью PGR и активными генами миометрия. 1431, 589 и 183 активных гена, которые связаны с NP-отличными, общими NP-TP и TP-отличными сайтами, занимающими PGR, как показано в таблице 8, были подвергнуты анализу пути изобретательности. Пути, которые имеют значение обогащения p менее 0,05, отмечены голубым цветом.
Ретроградный транспорт TrkB-содержащих аутофагосом через адаптер AP-2 опосредует сложность нейронов и предотвращает нейродегенерацию
Животные
Животных размещали небольшими группами в 12-часовом цикле свет / темнота с пищей и водой ad libitum .Все эксперименты на животных были одобрены этическими комитетами LAGeSo Berlin и LANUV Cologne и проводились в соответствии с указаниями комитета. Крысы Wistar для экспериментов, представленных на рис. 2c и дополнительном рис. 6f – i, были получены из зоопарка Медицинского центра им. Мосаковского Польской академии наук (Варшава, Польша). Мыши с условным AP-2 KO (AP-2 lox / lox × индуцибельный CAG-Cre (ссылка 60) и AP-2 lox / lox × Tubulin α1 Cre) были описаны ранее 26 .ATG5 lox / lox (B6.129S-Atg5 tm1Myok (RBRC02975)) мыши 15 были получены из RIKEN BioResource Center (BRC, Ибараки, Япония). Мыши с условным ATG5 KO были созданы путем скрещивания мышей ATG5 lox / lox с линией CAG-Cre, индуцируемой тамоксифеном (B6.Cg-Tg (CAG-cre / Esr1 *) 5Amc / J; лаборатория Джексона).
Плазмиды
Экспрессионные плазмиды, кодирующие HA-меченный AP-2α A WT или дефектный по связыванию LC3 мутант AP-2α A были щедрым подарком от доктора П.Грингард (Университет Рокфеллера, Нью-Йорк, США) 29 . eGFP-mRFP-LC3a был создан из cMyc-LC3a, щедро предоставленного доктором F. Reggiori (Утрехтский университет, Нидерланды). mRFP-TrkB был любезным подарком от доктора Ф. Сауду (Институт нейробиологии, Гренобль, Франция). eGFP-TrkB был сконструирован путем помещения кодирующей последовательности TrkB, лишенной собственного сигнального пептида, ниже сигнального пептида ApoER в рамке с eGFP. Плазмиды pSUPER (ссылка 61), pEGFPC2-BIO, HA-BirA (ссылка 62) любезно предоставлены доктором С.К. Хугенрад (Утрехтский университет, Нидерланды). β-актин-GFP и pEGFP-BIO-β-гал (AviGFP-β-gal) были описаны ранее 63,64 . pEGFP-BIO-p150 Glued (AviGFP-p150 Glued ) был получен путем клонирования кДНК p150 Glued крысы, полученной с помощью ПЦР с использованием библиотеки кДНК крысы, в pEGFPC2-BIO. p150 Приклеенная последовательность кшРНК (5′-gatcgagagacagtcatca-3 ‘) была сконструирована против крысиной p150 Приклеена мРНК и клонирована в вектор pSuper. AP2mu-IRES-mRFP-in-AAV-HBA-EWB был получен путем введения полноразмерной кДНК, кодирующей µ2-адаптин мыши, в основной вектор AAV-HBA-EWB через сайты рестрикции Nhe1 / Age1.IRES-mRFP, полученный с помощью ПЦР слияния, вставляли в полученную конструкцию через сайты рестрикции Age1 / Bsp1407I. Плазмида, кодирующая человеческий LC3b с GST-меткой, была подарком доктора Фолькера Дотча (Франкфуртский университет, Германия). GST-меченный человеческий стонин 2 (аминокислоты 1–555) был описан до 65 . mCherry-ATG12 был щедрым подарком доктора Майкла Ламмерса (CECAD, Кельнский университет). Mito-mCherry был любезным подарком доктора Елены Ругарли (CECAD, Кельнский университет), Munc-13-1-eYFP был подарком доктора Нильса Броза (Макс Планк для Exp.Медицина, Геттинген, Германия).
Приготовление культур нейрональных клеток и трансфекция
Нейроны из коры и гиппокампа выделяли от постнатальных мышей на p1–5, как описано ранее. 66 . Клетки трансфицировали через 7–9 дней in vitro (DIV) с использованием оптимизированного протокола фосфата кальция 66 .
Чтобы инициировать гомологичную рекомбинацию в нейронах от флоксованных животных, экспрессирующих индуцируемую тамоксифеном рекомбиназу Cre, культивируемые нейроны обрабатывали 0.25 мкМ (Z) -4-гидрокситамоксифен (Sigma) сразу после посева (DIV0). Во время обновления среды на DIV1 и DIV2 использовали равные концентрации тамоксифена (0,25 мкМ). К контрольным нейронам добавляли этанол в количестве, равном концентрации тамоксифена (0,25 мкМ). В некоторых случаях гомологичная рекомбинация была индуцирована на более поздней стадии путем обработки культивированных нейронов от животных, подвергшихся флоксированию, экспрессирующих рекомбиназу Cre, индуцируемую тамоксифеном, 0,25 мкМ (Z) -4-гидрокситамоксифеном (Sigma) на DIV8. Для экспериментов по спасению гомологичная рекомбинация была индуцирована применением тамоксифена в DIV0.Конструкцию AP-2μ-mRFP вводили на DIV8, а нейроны анализировали на DIV14.
Иммуноцитохимия и анализ культивируемых нейронов
Нейроны фиксировали на DIV 13–16 в 4% параформальдегиде (PFA) в фосфатно-солевом буфере (PBS) в течение 15 минут при комнатной температуре, промывали и пропитывали 0,3% Triton X-100 ( Tx) в течение 15 мин при комнатной температуре. После блокирования PBS, содержащим 10% нормальной козьей сыворотки (NGS) и 0,3% Tx, в течение 1 часа нейроны инкубировали с первичными антителами (см. Дополнительную таблицу 1) в течение 1 часа в PBS, содержащем 10% NGS и 0.3% Tx. Покровные стекла трижды промывали PBS (по 10 минут каждое) и инкубировали с соответствующими вторичными антителами (см. Дополнительную таблицу 1) в течение 30 минут (разбавленных 1: 400 в PBS, содержащем 0,3% Tx и 10% NGS). Затем покровные стекла трижды промывали в PBS и помещали в Immumount. Для обнаружения LC3b и Rab7 проницаемость и блокирование проводили в 5% BSA и 0,3% сапонине. Тот же буфер использовали для разведения антител.
Нейроны были отображены на DIV 13–16 с разрешением 1024 × 1024, с восьмибитовой выборкой (без увеличения z) с помощью конфокального микроскопа Leica SP5 с использованием Plan-Apochromat × 63/1.32 масляный DIC-объектив с коррекцией как хроматических, так и сферических аберраций. Коэффициенты корреляции Пирсона (Rp) были определены в областях интереса (11,7 × 13,3 мкм) из необработанных необработанных двухканальных изображений с использованием функции анализа корреляции интенсивности из макроса колокализации в ImageJ (ссылка 67). Для количественного анализа флуоресцентных точек общая площадь нейрона была выбрана вручную с помощью инструментов выбора ImageJ. Флуоресцентные точки были определены с применением алгоритма «минимум» с автоматическим порогом, реализованного в ImageJ, и проанализированы с использованием модуля ImageJ «Анализ частиц» для определения количества флуоресцентных точек на мкм 2 .Все антитела, используемые для иммуноокрашивания, указаны в дополнительной таблице 1 (то есть IF).
Визуализация и анализ STED
Визуализация STED с синхронизированным детектированием выполнялась с использованием коммерческого микроскопа Leica SP8 TCS STED (Leica Microsystems), оснащенного лазером белого света с импульсным возбуждением (WLL; ширина импульса ∼80 пс, 80 МГц) частота повторения; NKT Photonics) и два лазера STED для истощения (непрерывная волна на 592 нм, импульсная на 775 нм). Импульсный лазер STED с длиной волны 775 нм запускался от WLL.В рамках каждого независимого эксперимента образцы были получены с одинаковыми настройками. Alexa 488 и Alexa 532 возбуждались с помощью импульсного WLL на 488 и 545 нм соответственно. Истощение произошло на длине волны 592 нм. Сигналы флуоресценции детектировались последовательно гибридными детекторами в соответствующих спектральных областях, отделенных от STED-лазера соответствующими дихроичными фильтрами. Изображения были получены с помощью HC PL APO CS2 × 100 / 1.40-N.A. масляный объектив (Leica Microsystems), формат сканирования 1024 × 1024, восьмибитовая выборка и 4.5, что дает размер пикселя 25,25 нм и 25,25 нм в размерах x и y соответственно. Коэффициенты корреляции Пирсона были определены в областях интереса (5,1 × 4,3 мкм) с использованием функции анализа корреляции интенсивности из макроса колокализации в ImageJ (ссылка 67).
Анализ Шолля культивируемых нейронов
Нейроны трансфицировали eGFP на DIV 8. В случае, если клетки обрабатывали факторами роста (BDNF и NGF, оба Peprotech), эти факторы добавляли на DIV 7 в количестве 50 нг / мл -1. .Клетки либо фиксировали на DIV 14/15 для AP-2μ KO и контрольных нейронов, либо на DIV20-22 для ATG5 KO и контрольных нейронов и обрабатывали, как указано выше. В случае, если гомологичная рекомбинация индуцировалась на DIV8, нейроны AP-2 KO фиксировали на DIV19-20. Нейроны получали с помощью конфокального микроскопа Leica SP5 с использованием масляного ДИК-объектива Plan-Apochromat × 63 / 1.32 с поправкой как на хроматические, так и на сферические аберрации. Нейроны сканировали с разрешением 1024 × 1024, восьмибитной выборкой, масштабированием 1 и шагом по оси 0.5 мкм. Анализ Шолля отдельных клеток выполняли с использованием макроса ImageJ Sholl Analysis Macro. Сложность нейронального ветвления рассчитывалась путем суммирования количества пересечений в пределах 200 мкм от тела клетки.
Живое изображение культивируемых нейронов
Нейроны были отображены на 12–16 DIV с использованием инвертированного микроскопа Zeiss Axiovert 200M с масляно-иммерсионным объективом × 40, предметным столиком с регулируемой температурой (37 ° C) и камерой CCD. Покадровые изображения нейронов, экспрессирующих TrkB-mRFP и / или mRFP-eGFP-LC3, получали каждую секунду с помощью Slidebook (Improvision Germany, Göttingen) в течение 30 с.Для экспериментов с голоданием нейроны перед визуализацией выдерживали в бессывороточной среде в течение 3 часов. Отдельные частицы были идентифицированы вручную в Slidebook. Анализ отслеживания отдельных частиц проводился с использованием протокола отслеживания частиц в Slidebook, а полученные отдельные треки проверялись вручную. Средняя скорость отдельных частиц была рассчитана путем определения среднего квадрата смещения между каждой парой последовательных кадров, усредненного по всем кадрам. Кимографы были созданы с помощью соответствующего модуля в Slidebook.Анализ частотного распределения проводился в Excel (Microsoft).
Иммуногистохимический анализ срезов головного мозга
Мышей умерщвляли на 3, 7, 14 или 18–21 сутки после рождения передозировкой кетамина / ромпуна (внутрибрюшинно, 10 мкл на 10 г массы тела) и транскардиально перфузировали 50 мл физиологического раствора. (0,85% NaCl, 0,025% KCl, 0,02% NaHCO3, pH 6,9, 0,01% гепарина, температура тела), затем 50 мл холодного (7-15 ° C) свеже деполимеризованного 4% (вес / объем) PFA (Merck) в 0,1 М PBS, pH 7,4. Мозг осторожно извлекали из черепа, фиксировали в течение ночи тем же фиксатором и помещали в смесь 20% (об. / Об.) Глицерина и 2% (об. / Об.) Диметилсульфоксида (VWR International) в 0.4 M PBS в течение 24 часов для криозащиты. Замороженные горизонтальные, корональные или сагиттальные срезы (40 мкм) собирали шестью сериями в 0,1 М PBS. Для иммуноокрашивания соответствующие срезы гиппокампа от однопометников WT и KO обрабатывали одновременно. Срезы из второй серии промывали трижды в PBS (3 × 15 мин каждый) с последующей промывкой несколько раз в PBS, содержащем 0,3% Triton X-100 (9 × 20 мин каждый). Срезы предварительно инкубировали с PBS, содержащим 5% (об. / Об.) NGS и 0,3% Triton X-100, в течение 1 часа, а затем инкубировали с первичным антителом при 4 ° C в течение 48 часов (список антител см. В дополнительной таблице 1).Затем срезы промывали девять раз по 20 минут каждый в 0,3% Triton X-100 в 0,1 M PBS и инкубировали с вторичными антителами, конъюгированными с Alexa (1: 400), в течение 12 часов с использованием стандартных методик. Наконец, срезы помещали на предметные стекла, покрытые желатином. Срезы получали с разрешением 1024 × 1024 с восьмибитовой выборкой (без увеличения z) с помощью конфокального микроскопа Leica SP5 с использованием масляного DIC-объектива Plan-Apochromat × 63 / 1.32, с поправкой на хроматические и сферические аберрации.Флуоресцентные точки были определены в области интереса за вычетом фона (90 × 83 мкм) с использованием алгоритма автопороговой максимальной энтропии, реализованного в ImageJ, и проанализированы с использованием модуля ImageJ «Анализ частиц» для определения количества флуоресцентных точек на мкм 2 . Все антитела, используемые для иммуноокрашивания, указаны в дополнительной таблице 1 (под IF).
Окрашивание по Нисслю
Срезы помещали в 0,2% раствор желатина в 250 мМ трис-HCl и сушили в течение ночи при 40 ° C на нагревательной пластине.Установленные срезы регидратировали в течение 1 мин в воде и окрашивали в течение 5–10 мин в 0,1% растворе крезилового фиолетового. Затем срезы промывали три раза (по 2 минуты каждый) в воде и обезвоживали с использованием серии восходящего этанола (50, 70, 80, 90%) в течение 2 минут каждый. После промывки срезов в 96% этаноле их обесцвечивали 0,5% уксусной кислотой и дважды промывали 100% этанолом (по 2 мин каждый), инкубировали с ксилолом в течение 2 мин и затем устанавливали с использованием энтеллана.
Импрегнация нейронов серебром Гольджи
in vivoИмпрегнация серебром Гольджи была выполнена на перфузируемых срезах мозга мышей p20 толщиной 200 мкм с использованием набора FD Rapid Golgi Stain Kit (FD Technologies).Клетки были реконструированы и проанализированы с использованием Neurolucida (MBF Bioscience).
Окрашивание мозга фторо-нефритом С
Фтор-нефрит С (FJC) производное полианионного флуоресцеина, которое может чувствительно и избирательно связываться с дегенеративными нейронами 68 . Для визуализации дегенерирующих нейронов срезы головного мозга перфузированных p20 WT и AP-2 KO помещали на слайды, покрытые желатином, и подвергали окрашиванию FJC в соответствии с протоколом производителя (набор для окрашивания Fluoro-Jade C, Biosensis).Срезы получали с помощью конфокального микроскопа Leica SP5, оснащенного фильтром FITC.
Анализ эндоцитоза TrkB в культивируемых нейронах
Нейроны WT гиппокампа и AP-2 KO получали, как описано выше, и трансфицировали на DIV 8 с помощью eGFP-TrkB. На DIV 13 покровные стекла промывали один раз в 1 мл бессывороточной среды, содержащей NBA, с отрегулированной осмолярностью. Для индукции захвата антител нейроны инкубировали в течение 15 минут или, альтернативно, в течение 30 минут при 37 ° C в предварительно нагретых 70 мкл бессывороточной среды с добавлением 50 нг мл -1 BDNF человека (Peprotech) и в разведении 1: 500. GFP-антитело (поликлональные кроличьи, Abcam, ab6556).Условия контроля соответствовали инкубации в течение 30 мин при 4 ° C в предварительно охлажденном растворе антитела / BDNF. Через указанные временные точки покровные стекла переносили в новый планшет с лунками, содержащий ледяной PBS, и промывали один раз в течение 1 мин ледяной 0,2 М уксусной кислотой и 0,5 М NaCl в MQ. После двух дополнительных стадий отмывки с использованием ледяного PBS нейроны фиксировали в течение 10 мин при комнатной температуре 4% PFA / 4% сахарозы и трижды промывали PBS. Впоследствии клетки блокировали в PBS с добавлением 10% NGS (блокирующего буфера) в непроницаемых условиях в течение 30 мин.Пул поверхностно-связанных антител иммуноокрашивали путем инкубации с козьим анти-кроличьим антителом Alexa Fluor 647 (Invitrogen, 1: 100 в блокирующем буфере) в течение 1 часа при комнатной температуре. Затем клетки трижды промывали PBS и фиксировали в течение 10 мин при комнатной температуре 2% PFA / 2% сахарозы с последующими тремя промывками PBS. Чтобы идентифицировать пул интернализованных антител, нейроны были пермеабилизированы, заблокированы в блокирующем буфере с добавлением 0,3% TX-100 в течение 20 минут и иммуноокрашены вторичными антителами, меченными козьими антителами против кролика Alexa Fluor 568 (1: 200, блокирующий буфер с добавлением 0.3% Tx) в течение 30 мин при комнатной температуре. Покровные стекла трижды промывали PBS и устанавливали с помощью Immumount. Клетки были визуализированы с помощью Leica SP8 и проанализированы с помощью ImageJ. Количество интернализованных рецепторов eGFP-TrkB рассчитывали, принимая соотношение между средним серым значением интернализованного антитела GFP и средним серым значением общих уровней экспрессии eGFP-TrkB.
трансфекция миРНК клеток HeLa и плазмид
Клетки HeLa подвергали двум циклам трансфекции (дни 0 и 2) миРНК с использованием олигофектамина (Life Technologies) в соответствии с протоколом производителя.Для дополнительной временной сверхэкспрессии плазмиды трансфицировали на 4 день с использованием реагента для трансфекции ДНК X-tremeGENE 9 (Roche). Для подавления использовалась следующая миРНК: AP-2α 5′-AAGAGCAUGUGCACGCUGGCCA. Скремблированная последовательность AP-2μ. 5′-GTAACTGTCGGCTCGTGGTTT использовали в качестве контрольной siRNA.
Поглощение трансферрина клетками HeLa
Клетки HeLa, посеянные на покровные стекла, покрытые матригелем (BD Biosciences), испытывали недостаток сыворотки в течение 1 часа и обрабатывали 25 мкг мл -1 Tf-Alexa647 (Life Technologies) в течение 10 минут при 37 ° C. ° C.Клетки дважды промывали ледяным PBS и кислотой при pH 5,3 (0,1 М Na-ацетат, 0,2 М NaCl) в течение 1 мин на льду. Покровные стекла дважды промывали ледяным PBS и фиксировали 4% PFA в течение 30 мин при комнатной температуре. Поглощение трансферрина анализировали с помощью микроскопа Nikon Eclipse Ti, оснащенного масляным иммерсионным объективом × 40, и количественно оценивали с помощью программного обеспечения ImageJ.
Иммуноблот-анализ экстрактов головного мозга мыши
Соматосенсорные коры головного мозга гомогенизировали в буфере для лизиса (20 мМ Hepes-KOH, pH 7.4, 100 мМ KCl, 2 мМ MgCl 2 , 1% Triton X-100, дополненный 1 мМ PMSF и смесью ингибиторов протеазы и фосфатазы млекопитающих) с использованием гомогенизатора с тефлоновым стеклом. Лизат инкубировали 20 минут на льду перед центрифугированием при 17000 g в течение 10 минут при 4 ° C. Концентрацию белка определяли методом Брэдфорда. Образцы анализировали с помощью SDS – PAGE и иммуноблоттинга. Белки детектировали с использованием вторичных антител, связанных с HRP, в хемолюминесцентной реакции или с помощью системы Odyssey LiCor.Все антитела, используемые для иммуноблоттинга, указаны в дополнительной таблице 1 (под WB). Изображения на рис. 7b, дополнительных рис. 3c, 4g, h, 5g, i, l, 6f, 7e были обрезаны для презентации. Полноразмерные изображения представлены на дополнительном рисунке 8.
Иммунопреципитация
Dynabeads Protein G (50 мкл) промывали в буфере для лизиса (150 мМ NaCl, 1 мМ CaCl 2 , 1 мМ MgCl 2 , 20 мМ HEPES -NaOH, pH 7,5) с добавлением 0,3% CHAPS и протеазы, а также ингибиторов фосфатазы.Гранулы инкубировали с 10 мкг антитела в течение 15 мин при комнатной температуре, а затем несвязавшееся антитело удаляли промыванием. Лизаты головного мозга крысы получали путем гомогенизации в гомогенизаторе стекло-тефлон с 30 ходами в буфере для лизиса (10 × объем / вес) в отсутствие детергента. Для лизиса ткани гомогенат смешивали в соотношении 1: 1 с буфером для лизиса, содержащим 0,6% CHAPS, и вращали в течение 1 ч при 4 ° C. Клеточный дебрис удаляли и концентрацию белка доводили до 3 мг / мл -1 добавлением буфера для лизиса, содержащего 0.3% ЧАПОВ. лизат (700 мкл) инкубировали в течение ночи при 4 ° C со свежеприготовленными Dynabeads. Образцы промывали трижды, используя 300 мМ NaCl, 1 мМ CaCl 2 , 1 мМ MgCl 2 , 0,1% CHAPS, 20 мМ HEPES-NaOH, pH 7,5. Белки элюировали в буфере для образцов SDS и анализировали с помощью SDS-PAGE и иммуноблоттинга. Все антитела, используемые для экспериментов по иммунопреципитации, указаны в дополнительной таблице 1 (под IP). Изображения на рис. 2c были обрезаны для презентации. Полноразмерные изображения представлены на дополнительном рис.8.
Связывание биотинилированного p150
Приклеенное к β2-ухуM-280 стрептавидин Dynabeads блокировали в течение 1 часа в 20 мМ HEPES-KOH, pH 7,5, 150 мМ KCl с добавлением 0,2 мг мл -1 БСА и 20% глицерин. Гранулы промывали буфером для лизиса (20 мМ HEPES-KOH, pH 7,5, 150 мМ KCl, 0,3% CHAPS) с добавлением ингибиторов протеаз и фосфатаз. Клетки HEK293T, коэкспрессирующие AviGFP-p150 Glued или AviGFP-β-галактозидазу в качестве отрицательного контроля, лизировали в течение 15 мин на льду в буфере для лизиса.Супернатант добавляли к приготовленным стрептавидиновым шарикам M-280 Dynabeads на 1 час при 4 ° C при вращении. Затем шарики промывали четыре раза в промывочном буфере (20 мМ HEPES, pH 7,5, 500 мМ KCl, 0,1% CHAPS) и инкубировали с 0,2 мг мл -1 His 6 -AP-2β домен придатка в связывающем буфере: 20 мМ HEPES-pH 7,5, 300 мМ KCl и 0,1% CHAPS) в течение 2 ч при 4 ° C при вращении. Наконец, шарики промывали четыре раза буфером для связывания, элюировали буфером для образцов SDS и анализировали с помощью SDS-PAGE и последующего иммуноблоттинга.Изображения на рис. 2d были обрезаны для презентации. Полноразмерные изображения представлены на дополнительном рис. 8.
Анализ лизата мозга
Слитые белки, меченные GST и His, подвергали аффинной очистке с помощью аффинной хроматографии на основе глутатион-сефарозы или Ni-NTA. Слитые с GST белки хранили при 4 ° C в PBS. Лизаты мозга мышей, экстрагированные детергентом, получали, как описано в 66 . Вкратце, мозг мышей гомогенизировали в буфере для лизиса (10 мМ HEPES, pH 7.4, 150 мМ NaCl, 2 мМ DTT, 0,05% Triton X-100, с добавлением ингибиторов протеаз и фосфатаз) и инкубировали на льду в течение 30 минут перед центрифугированием при 65000 × об / мин. в течение 15 мин при 4 ° C. Супернатант добавляли к 50 мкг рекомбинантного очищенного GST или GST-AP-2a A / C и вращали в течение 2 ч при 4 ° C. Образцы промывали пять раз буфером для лизиса, элюировали буфером для образцов SDS и анализировали с помощью SDS-PAGE и иммуноблоттинга. Изображения на рис. 2b, e и дополнительном рис. 2b, c были обрезаны для презентации.Полноразмерные изображения представлены на дополнительном рисунке 8.
Прямое связывание LC3b с AP-2α-присоединенными доменами
Рекомбинантно очищенный GST или GST-AP-2α A / C -привязанные домены (10 мкг) и His 6 -LC3b (5 мкг) инкубировали в связывающем буфере (150 мМ NaCl, 10 мМ HEPES, pH 7,5, 5 мМ имидазол, 2 мМ DTT и 0,005% Triton X-100) в течение 1 ч при 4 ° C на вращающееся колесо. Образцы промывали четыре раза в буфере для связывания, белки элюировали буфером для образцов и анализировали с помощью SDS-PAGE и иммуноблоттинга на LC3b.Изображения на рис. 2а были обрезаны для презентации. Полноразмерные изображения представлены на дополнительном рис. 8.
Электронная микроскопия
Нейроны погружали в 2% -ный глутаральдегид, забуференный PBS, с последующей постфиксацией 1% OsO 4 , 1,5% гексацианоферрата калия и окрашиванием уранилацетатом. После этого нейроны дегидратировали в градиенте метанола и оксида пропилена с последующей инфильтрацией эпоксидной смолы. После полимеризации эпоксидной смолы покровные стекла удаляли с плоских залитых культур с помощью жидкого азота.Срезы размером пятьдесят нанометров были вырезаны, контрастированы уранилацетатом и цитратом свинца и проанализированы на просвечивающем электронном микроскопе Zeiss 900. Изображения были получены с помощью камеры Olympus MegaViewIII или цифровых камер Olympus Morada G2 при увеличении × 30 000.
Количественная ОТ-ПЦР в реальном времени (qRT-PCR)
Суммарная РНК из культивированных этанолом или обработанных тамоксифеном нейронов из AP-2μ lox / lox : мышей CAG-Cre экстрагировали с использованием реагента TRIzol (амбион, РНК, Технологии жизни).После гомогенизации образцов реагентом TRIzol добавляли хлороформ, и водный слой, содержащий РНК, выделяли и осаждали изопропанолом. Обратную транскрипцию в кДНК проводили с использованием набора для обратной транскрипции кДНК высокой емкости (4368814, Thermo Scientific) в соответствии с инструкциями производителей. qRT – PCR выполняли на приборе LightCycler 1.5 с использованием набора Fast Start DNA Master SYBR Green I (Roche). Последовательности праймеров перечислены в дополнительной таблице 2.Образцы были проанализированы в двух экземплярах, и сигналы BDNF были нормализованы по интенсивности GAPDH.
Статистический анализ
Для анализа экспериментов статистически значимые оценки были получены из независимых экспериментов ( n ). Статистическая значимость между двумя группами для всех нормально распределенных исходных данных, за исключением лечения факторами роста, оценивалась с помощью двустороннего непарного теста студента t . Влияние BDNF и NGF на сложность нейронов оценивали с помощью парных тестов Стьюдента t .Статистическая значимость между более чем двумя группами для всех нормально распределенных исходных данных (рис. 4b, f) оценивалась с использованием однофакторного дисперсионного анализа (для определения статистической значимости между группами использовался апостериорный тест Tukey ). Все нормализованные данные (рисунки 4h и 7c, d, дополнительные рисунки 3d, 4i, 5h, j, m) были оценены с использованием однократного теста Стьюдента t . Значимые различия были приняты при P <0,05. Для прямоугольных диаграмм медиана разделяет прямоугольник, в то время как верхняя граница прямоугольника соответствует третьему квартилю, а нижняя граница соответствует первому квартилю.Минимальные и максимальные значения отображаются в виде полосок снизу и сверху поля.
Антитела
Обзор всех антител, использованных в этом исследовании, приведен в дополнительной таблице 1.
Доступность данных
Данные, подтверждающие выводы этого исследования, можно получить у соответствующих авторов по разумному запросу.
Страница не найдена
Моя библиотека
раз-
-
- Моя библиотека
Интерактивная муха, Drosophila
Msn2p и частично избыточный фактор Msn4p являются ключевыми регуляторами стресс-чувствительного гена. экспрессия в Saccharomyces cerevisiae .Они необходимы для транскрипции ряда генов. кодирование белков со стресс-защитными функциями. И Msn2p, и Msn4p представляют собой цинковые пальцы Cys2His2. белки и связываются с элементом стрессового ответа (STRE). Исследования отпечатков пальцев in vivo показывают, что оккупация STRE усиливается в стрессированных клетках и зависит от присутствия Msn2p и Msn4p. Оба фактора накапливаются в ядре в стрессовых условиях, таких как тепловой шок, осмотический стресс, голодание по источникам углерода, а также в присутствии этанола или сорбата.Стресс-индуцированная ядерная локализация происходит быстро, обратимо и не зависит от синтеза белка. Ядерная локализация Msn2p и Msn4p обратно коррелирует с уровнями цАМФ и протеинкиназы A (ПКА) деятельность. Области со значительной гомологией, разделяемой между Msn2p и Msn4p, достаточно для придают регулируемую стрессом локализацию слитого белка SV40-NLS-GFP. Серин в аланин или аспартат замены в консервативном консенсусном сайте PKA отменяют ядерный экспорт, управляемый цАМФ, и цитоплазматическая локализация в нестрессированных клетках.Предполагается, что стресс и цАМФ-регулируемые внутриклеточные локализация Msn2p является ключевым этапом STRE-зависимой транскрипции и общего стресса. ответ (Гёрнер, 1998).
Было проведено исследование роли цАМФ-зависимой протеинкиназы A (PKA) в индукции раннего мезодермальные маркерные гены goosecoid и no tail по активину в эмбрионах рыбок данио. После лечения активином Клетки бластулы рыбок данио демонстрируют быстрое и временное повышение активности PKA.В этих клетках активин быстро индуцирует экспрессия генов немедленного раннего ответа goosecoid и no tail . Стимуляция и ингибирование ПКА активином, соответственно, усиливает и снижает индукцию экспрессии мРНК goosecoid и no tail . Подобные эффекты ПКА наблюдаются стимуляция и ингибирование индукции активином конструкции промотора гусекоид рыбок данио 1,8 т.п.н. В индукция активином фрагмента промотора гусекоида рыбок данио , который опосредует немедленный ранний ответ на активин, является блокируется ингибированием PKA.Активация только PKA не оказывает никакого эффекта в этих экспериментах. Наконец, ингибирование PKA в целые эмбрионы за счет сверхэкспрессии доминантной негативной регуляторной субъединицы PKA снижает экспрессию no tail и goosecoid , тогда как экспрессия even-skipped1 остается неизменной. Сверхэкспрессия каталитической субъединицы PKA в эмбрионы не влияют на экспрессию гусекоид, без хвоста или с четным пропуском1 . Эти данные показывают, что в диссоциированных бластулах PKA требуется, но ее недостаточно для передачи сигналов активина в направлении индукции goosecoid и no tail .У интактных рыбок данио У эмбрионов PKA способствует индукции goosecoid и no tail , хотя это не является ни необходимым, ни достаточным (Joore, 1998).
Стимуляция клеток индукторами NF-kappaB (Rel-протеин, родственный Drosophila Dorsal), такими как LPS и IL-1, приводит к деградации IkappaB-alpha и белки IkappaB-ß (гомологи Drosophila Cactus) и транслокация NF-kappaB в ядро. Кроме физическое разделение неактивного NF-kappaB на цитозоль, транскрипционная активность NF-kappaB регулируется через фосфорилирование NF-kappaB p65 протеинкиназой A (PKA).Каталитическая субъединица PKA (PKAc) поддерживается в неактивном состоянии через связь с IkappaB-alpha или IkappaB-ß в Комплекс NFkappa-B-IkappaB-PKAc. Сигналы, которые вызывают деградацию IkappaB, приводят к активации PKAc в цАМФ-независимый способ и последующее фосфорилирование p65. Следовательно, этот путь представляет собой новый механизм для цАМФ-независимой активации PKA и регуляции активности NF-каппа B (Zhong, 1997).
Вторые мессенджеры цАМФ и инозитол-1,4,5-трифосфат вовлечены в обоняние различных видов.Ответ цГМФ, индуцированный одорантом, исследовали с использованием препаратов ресничек и первичных обонятельных культур. Одоранты вызывают замедленное и устойчивое повышение цГМФ. А Компонент этого ответа цГМФ обусловлен активацией одной из двух кинетически различных гуанилилциклаз ресничного рецептора кальцием и белком, активирующим гуанилилциклазу (GCAP). Образованный таким образом цГМФ служит для усиления сигнала цАМФ в виде цГМФ-зависимой протеинкиназы (PKG) путем прямой активации аденилатциклазы.цАМФ, в свою очередь, активирует цАМФ-зависимую протеинкиназу (ПКА), которая, в свою очередь, может действовать, негативно регулируя гуанилилциклазу, тем самым ограничивая сигнал цГМФ. Эти данные демонстрируют существование регуляторной петли, в которой цГМФ может усиливать сигнал цАМФ, и, в свою очередь, цАМФ негативно регулирует продукцию цГМФ через РКА. Таким образом, небольшой, локализованный, вызванный запахом ответ цАМФ может быть усилен для модуляции последующих ферментов трансдукции или транскрипционных событий (Moon, 1998).
Предпочтительное фосфорилирование определенных белков цАМФ-зависимой протеинкиназой (PKA) может быть частично опосредовано закреплением PKA в семействе якорных белков A-киназы (AKAP), расположенных в непосредственной близости от целевых белков.Считается, что это взаимодействие зависит от связывания типа II регуляторных (RII) субъединиц AKAP и важен для PKA-зависимой модуляции альфа-амино-3-гидрокси-5-метил-4-изоксазолепропионовая кислота / каинатный рецептор, Ca2 + канал L-типа, и канал KCa. Было высказано предположение, что целенаправленное нарушение работы гена повсеместно экспрессируемая субъединица RIIalpha выявляет те ткани и сигнальные события, которые требуют закрепления ПКА. Мыши с нокаутом RIIalpha выглядят нормальными и здоровыми.Во взрослых скелетных мышцах белок RIalpha уровни повышаются, чтобы частично компенсировать потерю RIIalpha. Тем не менее, сокращение как наблюдают уровни белка каталитической (C) субъединицы и общую киназную активность. Удивительно, но закрепленный PKA-зависимая потенциация канала Ca2 + L-типа в скелетных мышцах, нокаутированных по RIIalpha, также без изменений по сравнению с диким типом, хотя более чувствителен к ингибиторам PKA-AKAP взаимодействия. Субъединица C совместно локализуется с каналом Ca2 + L-типа в поперечных канальцах у дикого типа. скелетная мышца и сохранит эту локализацию в нокаутной мышце.Субъединица RIalpha связывает AKAP, хотя сродство в 500 раз ниже, чем субъединица RIIalpha. Потенцирование Канал Ca2 + L-типа в скелетных мышцах мышей с нокаутом RIIalpha предполагает, что, несмотря на более низкий сродства к связыванию AKAP, RIalpha способен к физиологически релевантным якорным взаимодействиям (Burton, 1997).
Использование комбинации оверлейного скрининга протеинкиназы A типа II, быстрой амплификации концов кДНК и поиска в базе данных, был собран и охарактеризован контиг из 9923 п.н., в котором открытая рамка считывания кодирует 1901-аминокислотную Заякоренный белок А-киназы (AKAP) с очевидной подвижностью в SDS-PAGE 220 кДа.Он был назван человеческим AKAP220. (hAKAP220). Аминокислотная последовательность hAKAP220 обнаруживает высокое сходство с AKAP220 крысы по 1167 C-концевым остаткам, но содержит 727 остатков на N-конце, не присутствующих в сообщенной последовательности AKAP220 крысы. МРНК hAKAP220 экспрессируется на высоком уровне в семенниках, изолированных сперматоцитах пахитенов и круглых сперматидах. В Белок hAKAP220 присутствует в мужских половых клетках и зрелой сперме. Иммунофлуоресцентная маркировка специфическими антитела указывает на то, что hAKAP220 локализован в цитоплазме премейотических пахитеновых сперматоцитов и в центросомы развивающихся постмейотических половых клеток, в то время как локализация средней части / центросомы обнаруживается в удлинении сперматоциты и зрелые сперматозоиды.Белок hAKAP220 вместе с фракцией PKA типов I и II и белком фосфатаза I устойчива к детергентной экстракции хвостов сперматозоидов, что предполагает связь со структурами цитоскелета. В Напротив, S-AKAP84 / D-AKAP1, который также присутствует в промежуточном элементе, извлекается при тех же условиях. Антисыворотка против hAKAP220 коиммунопреципитирует регуляторные субъединицы PKA как I, так и II типа в лизатах семенников человека, указывает на то, что hAKAP220 взаимодействует с обоими классами субъединиц R либо посредством отдельного, либо посредством общего связывания мотив (ы) (Reinton, 2000).
Ras-мутанты со способностью взаимодействовать с различными эффекторами сыграли решающую роль в идентификации Ras-зависимых сигнальных путей. Два мутанта, RasS35 и RasG37, которые различаются по своей способности связывать Raf-1, были использованы для изучения Ras-зависимой передачи сигналов в эпителиальных клетках щитовидной железы. Клетки щитовидной железы крыс Wistar зависят от тиреотропина (ТТГ) для роста. Хотя для митогенеза, стимулированного ТТГ, требуется Ras, ТТГ активирует протеинкиназу А (PKA) и подавляет передачу сигналов через Raf и каскад митоген-активируемой протеинкиназы (MAPK).Клетки, экспрессирующие RasS35 (мутант, связывающий Raf) или RasG37 (мутант, связывающий RalGDS), демонстрируют TSH-независимую пролиферацию. RasS35 стимулирует морфологическую трансформацию и независимый от закрепления рост. RasG37 стимулирует пролиферацию, но не трансформацию, как измерено этими индексами. ТТГ оказывает заметно различающиеся эффекты на мутанты Ras и временно подавляет фосфорилирование MAPK в клетках, экспрессирующих RasS35. Напротив, TSH стимулирует фосфорилирование MAPK и рост клеток, экспрессирующих RasG37.Мутанты Ras, в свою очередь, оказывают дифференциальное влияние на передачу сигналов ТТГ. RasS35 отменяет стимулированные ТТГ изменения морфологии клеток и экспрессию тиреоглобулина, в то время как RasG37 не влияет на эти активности. Вместе эти данные указывают на то, что перекрестная связь между Ras и PKA различает отдельные эффекторные пути Ras (Miller, 1998).
Ген супрессора опухоли Вильмса, WT1, кодирует фактор транскрипции из семейства цинковых пальцев, который связывается с GC-богатыми последовательностями и действует как активатор транскрипции или репрессор.WT1 белок играет решающую роль в развитии мочеполовой системы у млекопитающих; его функция считается сохраняется во время эволюции позвоночных. Накапливающиеся данные свидетельствуют о том, что WT1 регулирует подмножество генов, включая гены факторов роста и рецепторов факторов роста, мало что известно о регуляторы или сигнальные каскады, которые могут модулировать функцию WT1. В Белок WT1, экзогенно экспрессируемый в фибробластах, фосфорилируется in vivo; лечение с форсколин, который активирует цАМФ-зависимую протеинкиназу (PKA) in vivo, индуцирует фосфорилирование дополнительных сайтов в WT1.Сайты индуцированного форсколином фосфорилирования были идентифицированы как Ser-365 и Ser-393, которые лежат в домене цинковых пальцев в цинковых пальцах 2 и 3 соответственно. Фосфорилаты PKA WT1 на Ser-365 и Ser-393 in vitro, а также на дополнительных сайтах. Это фосфорилирование отменяет ДНК-связывающая активность WT1 in vitro. Использование мутантов WT1, в которых Ser-365 и Ser-393 являются мутировали в Ala индивидуально и в комбинации, было показано, что фосфорилирование этих сайтов имеет решающее значение для ингибирования связывания ДНК in vivo.Таким образом, коэкспрессия каталитической субъединицы PKA с диким тип WT1 снижает уровень ДНК-связывающей активности WT1, обнаруженной в ядерных экстрактах, и снижает активность репрессии транскрипции in vivo. В отличие от WT1 дикого типа, весь сайт фосфорилирования мутанты сохраняют значительную ДНК-связывающую активность и репрессивную активность в присутствии PKA. Анализ мутантов показывает, что фосфорилирование Ser-365 и Ser-395 оказывает аддитивное ингибирующее действие. эффекты на связывание ДНК WT1 in vivo и что фосфорилирование в обоих сайтах необходимо для нейтрализация репрессивной активности.Таким образом, можно сделать вывод, что PKA модулирует активность WT1. in vivo посредством фосфорилирования Ser-365 и Ser-393, что ингибирует связывание ДНК. Это в свою очередь приводит к снижению репрессии транскрипции WT1. Эти данные являются первым доказательством того, что функция WT1 может модулироваться его фосфорилированием in vivo (Sakamoto, 1997).
Рыба данио нейрогенин 1 (гомолог дрозофилы Atonal) кодирует основной белок спираль-петля-спираль, который имеет общие структурные и функциональные характеристики пронейральных генов у Drosophila melanogaster . нейрогенин 1 экспрессируется в ранней нервная пластинка в доменах, содержащих больше клеток, чем первичные нейроны, которые, как известно, развиваются из этих регионы; его экспрессия модулируется передачей сигналов Delta / Notch, что позволяет предположить, что это цель латеральных торможение. Неправильная экспрессия нейрогенина 1 в эмбрионе приводит к развитию эктопических нейронов. Маркеры для разных подтипов нейронов эктопически не экспрессируются в одних и тех же паттернах в нейрогенин1 -инъецированных эмбрионов, что позволяет предположить, что окончательная идентичность эктопически индуцированных нейронов модулируется местными репликами.Для индукции эктопических мотонейронов нейрогенином1 требуется коэкспрессия доминантно-отрицательная регуляторная субъединица протеинкиназы A, внутриклеточного преобразователя Hedgehog сигналы. Ингибирование экспрессии ngn1 в боковой пластинке у эмбрионов, инъецированных конститутивно активной PKA, предполагает, что PKA может действовать как доминантный репрессор экспрессии ngn1 . Паттерн экспрессии эндогенного нейрогенина 1 в нервной пластинке расширяется в ответ на повышенный уровень передачи сигналов Hedgehog (Hh) или отменяется в результате ингибирования Hh сигнализация.Другие факторы, индуцируемые Hedgehogs, должны потребоваться в дополнение к Neurogenin1 для развития двигательных нейронов. Возможно, что экспрессия ngn1 в латеральной нервной пластинке контролируется с помощью BMP4 / 7 и что взаимодействие двух сигнальных центров вызывает полосатый паттерн Ngn1 в задней нервной пластинке. Вместе эти данные подтверждают, что сигналы Hh регулируют экспрессию нейрогенина 1 и впоследствии модулируют тип нейронов, продуцируемых активностью Neurogenin1 (Blader, 1997).
Белки гомеодомена Pbx млекопитающих (гомологи Drosophila Extradenticle) обеспечивают специфичность и повышенную аффинность связывания ДНК с другими гомеодоменными белками. Ранее было показано, что цАМФ-чувствительная последовательность (CRS1) бычьего CYP17 является сайтом связывания для Pbx1. Член второго семейства гомеодоменов млекопитающих, Meis1 (гомолог Drosophila: Homothorax), теперь также демонстрирует, что он связывает CRS1. белок при очистке с использованием аффинной хроматографии CRS1.CRS1-связывающие комплексы из ядерного экстракта клеток надпочечников Y1 содержат как Pbx1, так и Meis1. Это первый регуляторный элемент транскрипции, о котором сообщается как сайт связывания для членов семейства гомеодоменов Meis1. Pbx1 и Meis1 кооперативно связываются с CRS1, тогда как ни один белок не может связывать этот элемент в одиночку. Мутагенез элемента CRS1 указывает сайт связывания для Meis1, прилегающий к сайту Pbx. Все ранее идентифицированные партнеры по связыванию Pbx имеют мотивы, взаимодействующие с Pbx, которые содержат аминоконцевой остаток триптофана по отношению к гомеодомену, который необходим для кооперативного связывания с ДНК с Pbx.Члены семейства Meis1 содержат один аминоконцевой остаток триптофана по отношению к гомеодомену, но сайт-направленный мутагенез указывает на то, что этот остаток не требуется для кооперативного связывания CRS1 с Pbx. Таким образом, взаимодействие Pbx-Meis1 уникально среди комплексов Pbx. Meis1 также кооперативно связывает CRS1 с гомологами Pbx Extradenticle от Drosophila и ceh-20 из C. elegans , указывая на то, что это взаимодействие является эволюционно консервативным. Т.о., CYP17 CRS1 является элементом регуляции транскрипции, содержащим сайты связывания Pbx и Meis1, что позволяет этим двум гомеодоменным белкам связываться и потенциально регулировать cAMP-зависимую транскрипцию посредством этой последовательности (Bischof, 1998).
Основа этого ответа цАМФ еще не до конца понятна. Pbx1 усиливает цАМФ активированный транскрипционный ответ, опосредованный протеинкиназой А, регуляции CRS1 репортерного гена. Существует несколько возможных механизмов, с помощью которых протеинкиназа А может регулировать активность CRS1: (1) уровни одного или нескольких CRS1-связывающих белков могут регулироваться, например, на уровне экспрессии или трансляции гена. (2) Альтернативно, Pbx1 или Meis1 могут быть посттрансляционно модифицированы путем фосфорилирования, что может влиять на связывание ДНК, способность к димеризации или функцию трансактивации.Например, протеинкиназа А фосфорилирования гомеодоменного белка тироидного фактора транскрипции 1 участвует в экспрессии промотора гена сурфактантного белка B этим гомеодоменным белком. (3) Дополнительная возможность заключается в том, что протеинкиназа А модифицирует белок, не связанный с ДНК, который может взаимодействовать с комплексом Pbx-Meis1. (4) Что касается активности CRS1, могут быть другие компоненты связывающего комплекса CRS1, такие как белок 60 кДа, который был совместно очищен. Предварительные данные показывают, что этот белок может быть гомеодоменным белком Pknox1, который родственен Meis1.Идентификация этого белка, а также то, как протеинкиназа А может регулировать транскрипцию через этот элемент, изучается (Bischof, 1998).
Внутренние выпрямительные K + каналы ROMK контролируют почечную K + секрецию. Активность ROMK регулируется протеинкиназой A (PKA), но молекулярная механизм регуляции неизвестен. Поскольку прямое взаимодействие с мембранным фосфатидилинозитол 4, 5-бисфосфатом (PIP2) необходимо для активации канала была исследована роль PIP2 в регуляции ROMK1 с помощью PKA.Используя аденозин-5 ‘- [гамма-тио] трифосфат) (ATP [gammaS]) в качестве субстрата было обнаружено, что PKA не активирует напрямую каналы ROMK1 в мембранах, лишенных PIP2. Скорее, фосфорилирование PKA + ATP [gammaS] снижает концентрацию PIP2, необходимую для активации каналов. В анализах связывания раствора анти-PIP2 антитела связывают PIP2 и предотвращают взаимодействие с каналом PIP2. В вывернутых наизнанку мембранных участках антитела подавляют активность каналов. Лечение ПКА затем снижает чувствительность ROMK1 к ингибированию антителами, указывая на усиленное взаимодействие между PIP2 и фосфорилированными каналами.Напротив, мутация сайтов фосфорилирования PKA в ROMK1 снижает взаимодействие PIP2 с каналами. Таким образом, PKA активирует каналы ROMK1. за счет усиления взаимодействия PIP2-канала (Liou, 1999).
Индукция гена продинорфина вовлечена в среднесрочную и долгосрочную адаптацию во время приобретения памяти и боли. С помощью 5 ‘делеционного картирования и сайт-направленного мутагенеза промотора продинорфина человека было продемонстрировано, что как базальная транскрипция, так и индуцированная протеинкиназой A (PKA) транскрипция в клетках нейробластомы человека NB69 и SK-N-MC регулируются GAGTCAAGG. последовательность, центрированная в положении +40 в 5’-нетранслируемой области гена (названной DRE, для нижележащего регуляторного элемента).DRE подавляет базальную транскрипцию ориентационно-независимым и клеточно-специфическим образом, когда размещается ниже по течению от промотора гетерологичной тимидинкиназы. Эксперименты по Юго-Западному блоттингу и сшиванию УФ-лучей с ядерными экстрактами из клеток нейробластомы человека или человеческого мозга выявили белковый комплекс приблизительно 110 кДа, который специфически связывается с DRE. Лечение форсколином снижает связывание с DRE, и время его действия соответствует увеличению экспрессии гена продинорфина.Эти результаты предполагают, что в базовых условиях экспрессия гена продинорфина подавляется за счет занятия сайта DRE. После стимуляции PKA связывание с DRE снижается, а транскрипция увеличивается. Предложена модель активации продинорфина человека посредством PKA-зависимой дерепрессии в сайте DRE. Два независимых экспериментальных метода, УФ-сшивание и Юго-западный анализ, позволили начальная характеристика связывающей активности DRE, ядерного комплекса массой 110 кДа, который специфически связывается с DRE.Кроме того, более слабая полоса 55 кДа, наблюдаемая после УФ-сшивки, была оценена с немаркированным DRE. Возникает соблазн предположить, что комплекс массой 110 кДа представляет собой димер Белок массой 55 кДа, и эти две формы генерируют две DRE-специфические полосы с задержкой. DRE Связывающая активность была обнаружена воспроизводимо в тестируемых линиях клеток, экспрессирующих продинорфин, а также как в образцах хвостатого мозга человека. Последнее открытие еще больше усиливает функциональную значимость связывающей активности DRE, поскольку она связана с высоким уровнем экспрессии ген продинорфина в хвостатом отростке in vivo.Однако наблюдается также ядерная активность массой 110 кДа. в мозжечке человека. Поскольку продинорфин экспрессируется на очень низком уровне в мозжечке крыс, это предполагает, что комплекс связывающих белков DRE может участвовать в регуляции других генов, имеющих DRE или подобные DRE элементы в их промоторах (Carrion, 1998).
Резкие временные изменения, приводящие к звездчатой морфологии, индуцируются во многих типах клеток на лечение агентами, повышающими уровень внутриклеточного цАМФ.Тромбин полностью защищает клетки от этого индуктивный эффект цАМФ через рецептор тромбина. Показано защитное действие тромбина. быть Rho-зависимым. Экзофермент C3 Clostridium botulinum, который инактивирует функции RhoA, отменяет способность тромбина защищать клетки от реакции на повышенные уровни цАМФ. А конститутивно активированный мутантный белок RhoAV14 также предотвращает реакцию клеток на цАМФ. RhoA может быть специфически фосфорилирован по Ser-188 с помощью цАМФ-активируемой протеинкиназы A (PKA).RhoAV14A188, который не может фосфорилироваться PKA in vitro, больше эффективен, чем RhoAV14, в предотвращении реакции клеток на цАМФ и в индукции актинового стрессового волокна формирование. Это говорит о том, что фосфорилирование PKA RhoA ухудшает его биологическую активность in vivo. ROKalpha, серин / треониновая киназа, связанная с RhoA, также может препятствовать реакции клеток на цАМФ с изменением формы. Фосфорилирование RhoA с помощью PKA in vitro снижает связывание RhoA в ROKalpha.Эти результаты показывают, что RhoA и цАМФ играют антагонистическую роль в регуляции клеточная морфология и предполагают, что цАМФ-опосредованное подавление связывания RhoA с его эффектором ROKalpha может участвовать в этом антагонизме (Dong, 1998b).
Белки WAVE (см. Рубцы / волны у дрозофилы) являются членами семейства белков синдрома Вискотта-Олдрича (WASP). каркасных белков, которые координируют реорганизацию актина путем связывания Связанные с Rho низкомолекулярные ГТФазы к мобилизации Arp2 / 3 сложный.WAVE-1 был идентифицирован при скрининге на якорение киназы А в головном мозге крысы белки (AKAP), которые связываются с доменом Sh4 тирозинкиназы Абельсона (Abl). Рекомбинантный WAVE-1 взаимодействует с цАМФ-зависимой протеинкиназой (PKA) и Abl киназы при экспрессии в клетках HEK-293, и оба фермента очищаются совместно с эндогенная ВОЛНА из экстрактов головного мозга. Картографические исследования определили сайты связывания для каждой киназы. Эксперименты по конкуренции показывают, что взаимодействие PKA-WAVE-1 может регулироваться актином, потому что киназа связывается с сайтом, перекрывающим верпролин область гомологии, которая, как было показано, взаимодействует с актином.Иммуноцитохимический анализы швейцарских фибробластов 3T3 предполагают, что каркас киназы WAVE-1 является собирается динамически по мере того, как WAVE, PKA и Abl перемещаются к участкам актина реорганизация в ответ на лечение фактором роста тромбоцитов. Таким образом, ранее неизвестная функция предлагается для WAVE-1 как актин-ассоциированная каркасный белок, который рекрутирует PKA и Abl (Westphal, 2000).
Заякоренные белки А-киназы (AKAP) помогают регулировать внутриклеточную организацию циклической AMP-зависимой киназы (PKA) и актина в соматических клетках.Повышенные уровни цАМФ также помогают поддерживать остановку мейоза в незрелых ооцитах, при этом AKAP участвуют в качестве критических медиаторов, но плохо понимаются во время этого процесса. Это исследование проверяет гипотезу о том, что AKAP WAVE1 требуется во время оплодотворения млекопитающих, и идентифицирует ядерную локализацию WAVE1, которая не зависит от актина и связанных с актином белков (Arp). Эксперименты по иммунофлуоресценции и иммунопреципитации показывают перераспределение WAVE1 из коры в ооцитах зародышевых пузырьков (GV) в цитоплазматические очаги в ооцитах, остановленных во втором мейозе (Met II).После проникновения сперматозоидов WAVE1 перемещается в развивающиеся мужские и женские пронуклеусы. Ассоциация WAVE1 с регуляторной субъединицей PKA обнаруживается как в ооцитах Met II, так и в пронуклеарных зиготах, но взаимодействие с Arp 2/3 наблюдается только в ооцитах Met II. WAVE1 перераспределяется в цитоплазму при разрушении ядерной оболочки при митозе и концентрируется в борозде дробления во время деления эмбриональных клеток. Блокирование образования ядерных пор с помощью микроинъекции агглютинина зародышей пшеницы не ингибирует ядерную локализацию WAVE1, предполагая, что это событие предшествует образованию ядерной оболочки.Ни деполимеризация, ни стабилизация актина не влияют на распределение WAVE1. Однако стабилизация микротрубочек с помощью таксола перераспределяет WAVE1 в центросому, а антитела против WAVE1 предотвращают как ядерное распределение WAVE1, так и миграцию и расположение пронуклеусов. Эти находки показывают, что секвестрация WAVE1 в ядро необходима во время оплодотворения и является актин-независимым событием, которое опирается на динамические микротрубочки, но не на ядерные поры (Rawe, 2004).
цАМФ-зависимая протеинкиназа A (PKA) может модулировать синаптическую передачу, воздействуя непосредственно на неизвестные мишени в секреторном аппарате нейромедиатора.Был идентифицирован Snapin, белок с относительной молекулярной массой 15000, который участвует в нейротрансмиссии путем связывания с SNAP-25 в качестве возможной мишени. Делеционная мутация и сайт-ориентированные мутагенетические эксперименты точно определяют сайт фосфорилирования серина 50. PKA-фосфорилирование Snapin значительно увеличивает его связывание с синаптосомно-ассоциированным белком-25 (SNAP-25). Мутация Snapin серина 50 в аспарагиновую кислоту (S50D) имитирует этот эффект фосфорилирования PKA и усиливает ассоциацию синаптотагмина с растворимым белком присоединения чувствительного к N-этилмалеимиду фактора рецепторный (SNARE) комплекс.Кроме того, обработка срезов гиппокампа крысы негидролизуемым аналогом цАМФ индуцирует фосфорилирование Snapin in vivo и усиливает взаимодействие как Snapin, так и синаптотагмина с комплексом SNARE. В хромаффинных клетках надпочечников сверхэкспрессия мутанта Snapin S50D приводит к увеличению числа высвобождающих везикул. Эти результаты указывают на то, что Snapin может быть мишенью PKA для модуляции высвобождения медиатора посредством цАМФ-зависимого пути передачи сигнала (Chheda, 2001).
Представленные здесь результаты показывают, что Snapin может служить мишенью для PKA в синапсе, чтобы модулировать высвобождение передатчика и пластичность нейронов посредством пути вторичного мессенджера. Фосфорилирование Snapin по серину 50, как in vitro, так и in vivo, приводит к увеличению связывания Snapin с SNAP-25. Более того, это фосфорилирование, по-видимому, усиливает ассоциацию синаптотагмина, предполагаемого датчика Ca2 + для экзоцитоза, с собранным комплексом SNARE. В физиологических экспериментах сверхэкспрессия конститутивно фосфорилированного Snapin (S50D Snapin) приводит к увеличению количества готовых к высвобождению пузырьков в хромаффинных клетках надпочечников, тогда как сверхэкспрессия нефосфорилированной формы (S50A Snapin) снижает это количество.В контексте современной модели экзоцитоза в хромаффинных клетках эти результаты приводят к следующим выводам: (1) мутации S50D и S50A увеличивают величину устойчивого компонента экзоцитоза, указывая на то, что Snapin действует как положительный модулятор шаг заправки за счет увеличения постоянной скорости заправки; (2) S50D Snapin увеличивает размер экзоцитотического выброса, тогда как S50A Snapin уменьшает его. Т.о., фосфорилирование Snapin ведет к стабилизации готовых к высвобождению везикул, наиболее вероятно за счет снижения константы обратной скорости реакции прайминга-отмены прайминга (Chheda, 2001).
Активация каскада канонической митоген-активируемой протеинкиназы (MAPK) растворимыми митогенами блокируется в неприлипающих клетках. Он также блокируется в клетках, в которых активирована цАМФ-зависимая протеинкиназа (PKA). Ингибирование PKA позволяет стимулировать независимый от якорения каскад MAPK факторами роста. Этот эффект временный, и его продолжительность коррелирует с устойчивым фосфорилированием тирозина паксиллина и киназы фокальной адгезии (FAK) в неприлипающих клетках.Эффект чувствителен к цитохалазину D, что предполагает участие актинового цитоскелета в качестве важного фактора в обеспечении этой независимой от закрепления передачи сигналов. Интересно, что конститутивно активная p21-активируемая киназа (PAK) также обеспечивает независимую от якорения передачу сигналов MAPK. Кроме того, PKA негативно регулирует PAK in vivo, и хотя индукция независимой от закрепления передачи сигналов, возникающая в результате супрессии PKA, блокируется доминантно-негативным PAK, она заметно продлевается конститутивно активным PAK.Эти наблюдения показывают, что PKA и PAK являются важными регуляторами передачи сигнала, зависимого от закрепления (Howe, 2000).
Подсемейство PBC гомеодоменных белков TALE ( T hree- A mino-acid- L oop- E xtension) включает продукты позвоночных Pbx1 , Pbx2 , 79 и Pb Pbx4 и ген Drosophila extradenticle ( exd ). Белки PBC образуют стабильные гетеродимеры с белками MEINOX, которые принадлежат к другому подсемейству гомеодоменных белков TALE и включают продукты генов Meis и Prep позвоночных и ген Drosophila homothorax ( hth ).Регуляция функции белка PBC посредством субклеточного распределения является важным эволюционно консервативным механизмом формирования паттерна придатков. Исследованы процессы, контролирующие ядерный экспорт PBX1. В отсутствие белков MEINOX ядерный экспорт не является стандартным путем для субклеточной локализации PBX1. В различных клеточных фонах PBX1 может быть импортирован или экспортирован из ядра независимо от его способности взаимодействовать с белками MEINOX. Специфичный для клеточного контекста баланс между ядерным экспортом и импортом PBX1 контролируется доменом PBC-B, который содержит несколько консервативных остатков серина, соответствующих сайтам фосфорилирования для киназ Ser / Thr.Субклеточная локализация PBX1 коррелирует с состоянием фосфорилирования этих остатков, дефосфорилирование которых вызывает ядерный экспорт. Протеинкиназа A (PKA) специфически фосфорилирует PBX1 по этим серинам, и стимуляция эндогенной активности PKA in vivo блокирует ядерный экспорт PBX1 в мезенхимальных клетках дистальных конечностей. Эти результаты раскрывают новый механизм контроля ядерного экспорта PBX1 в дополнение к отсутствию белка MEINOX, который включает ингибирование PKA-опосредованного фосфорилирования в конкретных сайтах в домене PBC-B (Kilstrup-Nielsen, 2003).
Гистоновые деацетилазы (HDAC) – это ферменты, которые катализируют удаление ацетильных групп из остатков лизина гистоновых и негистоновых белков. Недавние исследования показывают, что они являются ключевыми регуляторами многих клеточных событий, включая пролиферацию клеток и развитие рака. HDAC класса I человека обладают гомологией с дрожжевым белком RPD3 и включают HDAC1, HDAC2, HDAC3 и HDAC8. Хотя HDAC1, HDAC2 и HDAC3 широко описаны, о HDAC8 почти ничего не известно.HDAC8 фосфорилируется циклической AMP-зависимой протеинкиназой A (PKA) in vitro и in vivo. Фосфоакцепторный сайт PKA HDAC8 представляет собой Ser (39), неконсервативный остаток среди HDAC класса I. Мутация Ser (39) в Ala усиливает деацетилазную активность HDAC8. Напротив, мутация Ser (39) в Glu или индукция фосфорилирования HDAC8 форсколином, мощным активатором аденилциклазы, снижает ферментативную активность HDAC8. Примечательно, что ингибирование активности HDAC8 за счет гиперфосфорилирования ведет к гиперацетилированию гистонов h4 и h5, подтверждая, что PKA-опосредованное фосфорилирование HDAC8 играет центральную роль в общем статусе ацетилирования гистонов (Lee, 2004).
Факторы bHLH HAND1 и HAND2 необходимы для развития сердца, сосудов, нейронов, конечностей и внеэмбрионального развития. В отличие от большинства белков bHLH, факторы HAND проявляют свойства беспорядочной димеризации. Фосфорилирование / дефосфорилирование посредством PKA, PKC и специфической гетеротримерной протеинфосфатазы 2A (PP2A) модулирует функцию HAND. Нацеливающая субъединица B56delta PP2A специфически взаимодействует с HAND1 и -2, но не с другими белками bHLH. PKA и PKC фосфорилируют белки HAND in vivo, и только B56delta-содержащие комплексы PP2A снижают уровни фосфорилирования HAND1.Во время дифференцировки стволовых клеток трофобласта RCHOI экспрессия B56delta подавляется, а фосфорилирование HAND1 увеличивается. Мутации в фосфорилированных остатках приводят к изменению димеризации и биологической функции HAND1. Взятые вместе, эти результаты подтверждают, что сайт-специфическое фосфорилирование регулирует функциональную специфичность HAND-фактора (Firulli, 2003).
Белки гетерогенных ядерных рибонуклеопротеиновых частиц (hnRNP) играют важную роль в процессинге мРНК у эукариот, но мало что известно о том, как они регулируются клеточными сигнальными путями.Белок, связывающий полипиримидиновый тракт (PTB или hnRNP I: Drosophila, гомолог Hephaestus), является важным регулятором альтернативного сплайсинга пре-мРНК, трансляции вирусной РНК и локализации мРНК. Нуклеоцитоплазматический транспорт PTB регулируется 3 ‘, 5’-цАМФ-зависимой протеинкиназой (PKA). PKA непосредственно фосфорилирует PTB по консервативному Ser-16, а активация PKA в клетках PC12 индуцирует фосфорилирование Ser-16. PTB, несущий мутацию Ser-16 в аланин, обычно накапливается в ядре.Однако экспорт этого мутантного белка из ядра значительно снижен в анализах челночного перемещения гетерокарионов. Напротив, гиперфосфорилирование PTB путем коэкспрессии с каталитической субъединицей PKA приводит к накоплению PTB в цитоплазме. Это накопление снова блокируется мутацией S16A. Точно так же в ооцитах Xenopus фосфо-Ser-16-PTB ограничен цитоплазмой, тогда как не-Ser-16-фосфорилированный PTB является ядерным. Таким образом, прямое фосфорилирование PKA PTB по Ser-16 модулирует нуклео-цитоплазматическое распределение PTB.Это фосфорилирование, вероятно, играет роль в цитоплазматической функции PTB (Xie, 2003).
Кальмодулин (CaM) является основным эффектором внутриклеточного действия Ca2 + почти во всех типах клеток. Был идентифицирован CaM-связывающий белок, обозначенный как регулятор передачи сигналов кальмодулина (RCS). G-белок-связанный рецептор (GPCR) -зависимая активация протеинкиназы A (PKA) приводила к фосфорилированию RCS по Ser55 и увеличивала его связывание с CaM. Phospho-RCS действует как конкурентный ингибитор CaM-зависимых ферментов, включая протеинфосфатазу 2B (PP2B, также называемую кальциневрином).
