Пять прорывных направлений в биологии, которые сделают жизнь лучше
Темпы развития машинного обучения и обработки больших данных приводят к новым научным открытиям, которые улучшают качество и продолжительность жизни человека. Соучредитель образовательной компании KOL Answer Петр Старокадомский рассказывает в колонке для Forbes, какие открытия в области биологии были самыми главными в 2021 году и благодаря чему они стали возможны
Первый за 40 лет ингибитор белка k-Ras для лечения рака
Одной из сенсаций биотеха в этом году стало одобрение американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) препарата Lumarkras (Sotorasib) — первого низкомолекулярного ингибитора (подавляющее или замедляющее то или иное действие вещество) белка k-Ras.
Неприступная ранее мишень была покорена благодаря новой технологии, когда молекула лекарства присоединяется к белку ковалентно — такой тип новых лекарств получил название «ковалентные ингибиторы». Это изобретение опирается на новейшие подходы к скринингу лекарств, более осмысленное понимание природы заболеваний: оно стало возможным за счет скоординированной работы тысяч врачей, химиков, биоинформатиков и молекулярных биологов.
Ковалентные ингибиторы позволят заново переосмыслить возможности старой доброй химии для клинической медицины. Онкология, нейродегенеративные заболевания, инфекции или метаболические нарушения — многие из болезней развиваются за счет нарушения функций мутантных белков, а ковалентные ингибиторы помогут врачам устранять вредоносные белки с минимальными побочными эффектами.
Материал по теме
Биомолекулярные конденсаты как новая клиническая мишень
Все живое состоит из клеток, которые можно дальше разделить на цитоплазму, ядро и многочисленные мембранные органеллы. Весь прошлый век общепринятой была парадигма, что все процессы ассоциируются с теми или иными мембранными структурами, которые делят клетку на отдельные биореакторы. Однако с накоплением экспериментальных данных стало понятно, что многие клеточные процессы протекают в структурах нового типа, названных безмембранными биомолекулярными конденсатами.
Оказалось, что сотни безмембранных конденсатов постоянно работают в наших клетках. Более того, нарушения их работы приводит к хроническим заболеваниям, а образование или растворение конденсатов прямо влияет на эффективность лечения того или иного метаболического процесса. В следующем году первые лекарственные кандидаты, модулирующие биомолекулярные конденсаты, начинают первые доклинические испытания на животных. В случае успеха, следующие годы могут привнести новое направление в фармакологии и биотех, вписав концепцию конденсатов в терминологию онкологии, нейродегенеративных и сердечно-сосудистых заболеваний.
мРНК и вирусные вакцины как препараты будущего
Этот год сильно отличается от предыдущего, если говорить про коронавирус и пандемию. Общество смогло защититься во многом благодаря быстрому запуску производств вакцин против COVID-19, две из которых (Pfizer-BioNTech и Moderna) являются новейшими мРНК вакцинами, а три других (AstraZeneca, Sputnik, J&J-Janssen) — другой новой платформой для аденовирусной доставки лекарства. В вакцинах используются разные технологии, однако они стабильно снижают вероятность развития тяжелой формы COVID-19 и сокращают число госпитализаций и смертей.
Пандемия внезапно вывела в топы еще год назад слабо знакомые большинству инвесторов темы РНК-технологий и аденовирусной доставки. И оказалось что эти технологии безграничны — на их основе сегодня разрабатывается и испытывается сотни генных терапий и противораковых вакцин. Этот год принес понимание, как масштабировать и организовывать логистику таких препаратов, а фарма снова показала свои лучшие стороны, справившись с очень сложными задачами. Однако главное, что произошло в 2021 году — это огромный массив клинических и пост-клинических данных по использованию двух новейших типов вакцин, что значительно ускорит разработку новых — не только от инфекций, но и для коррекции других хронических заболеваний.
Этот год принес понимание, как масштабировать и организовывать логистику таких препаратов, а фарма снова показала свои лучшие стороны, справившись с очень сложными задачами. Однако главное, что произошло в 2021 году — это огромный массив клинических и пост-клинических данных по использованию двух новейших типов вакцин, что значительно ускорит разработку новых — не только от инфекций, но и для коррекции других хронических заболеваний.
Материал по теме
Искусственный интеллект и моделирование сворачивания белка
Первые шаги в создании ингибитора k-Ras были сделаны на компьютерных моделях, когда очень точную пространственную структуру белка использовали как «замок» для подбора «ключа» — малых молекул, которые бы узнавали мутантные белки и не связывались бы со здоровыми. Для подобных расчетов требуется иметь точную 3D-модель белка-мишени.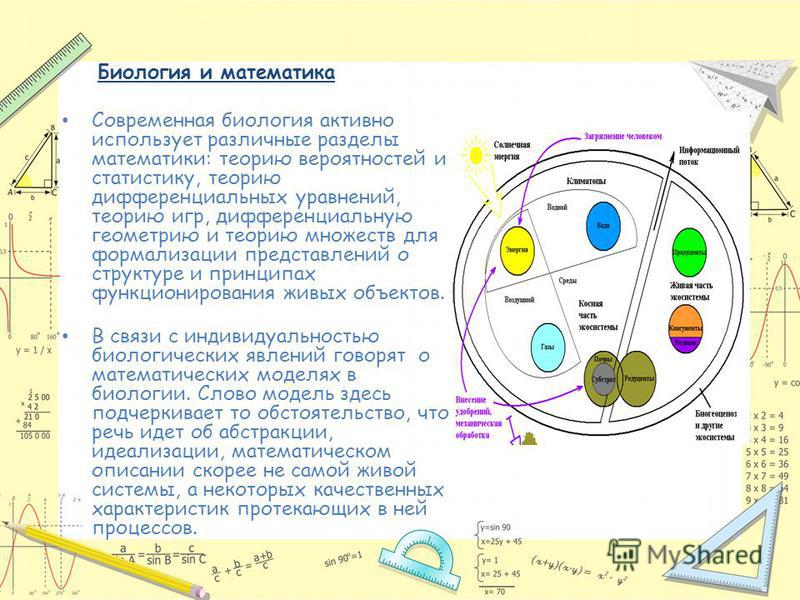 Раньше это делали только в качестве эксперимента, что долго и дорого. Кроме того, в организме более 20 000 разных белков, и 3D-структуру каждого из них получить невозможно технически.
Раньше это делали только в качестве эксперимента, что долго и дорого. Кроме того, в организме более 20 000 разных белков, и 3D-структуру каждого из них получить невозможно технически.
Поэтому в течение долгого времени несбыточной мечтой была идея научить компьютер строить 3D-модель любого белка по его генетическому коду. И наконец в этом году подразделение Alphabet по разработке искусственного интеллекта DeepMind объявило о создании ИИ-усиленного алгоритма AlphaFold. С помощью метода глубокого обучения, алгоритм научился предсказывать структуру любого белка с нужной точностью, а в июле 2021 года почти 99% всех белков человека были выложены в свободный доступ через базу данных Alphafold.
AlphaFold — это гигантский прорыв в понимании мира биологии. Точное моделирование белков открывает возможности для глубинного понимания природы заболеваний и подбора лекарств, а также для создания кибернетических моделей организма для проведения клинических испытаний новых типов лекарств на компьютерных симуляторах, вместо того, чтобы рисковать здоровьем пациентов и добровольцев.
Материал по теме
Симбиоз человеческого мозга и компьютера
Этим летом, ученые Гарварда в сотрудничестве с Google опубликовали первую 3D-схему одного кубического миллиметра мозга человека. Несмотря на микроскопический объем, схема содержит точное картирование всех активных соединений (говоря по-научному — синапсов, которых насчитали 133 млн на кубический миллиметр) между 57 000 нейронов.
Хотя такой объем представляет собой одну миллионную размера мозга человека, понимание комплексности наших нейросетей критически необходимо для развития терапий нейрозаболеваний, вроде болезни Альцгеймера, и когнитивных искажений. Опубликованная летом статья на bioxriv.org представляет собой фундамент будущих открытий нейробиологии, а по сути является первым шагом к мечте любого нейробиолога — полностью интерактивной карты головного мозга.
Например, это очень важно для разработки нейрокомпьютерного интерфейса. Тут невозможно не вспомнить успехи в области телепатического управления компьютером. В основе технологии — ультрачувствительные электроды, вживляемые в мозг пациента.
Самым запоминающимся в этом году была демонстрация телепатической игры в компьютерный теннис обезьянки из лаборатории компании Илона Маска Neuralink. Позитивный посыл очевиден: появились технологии, позволяющие парализованным людям, замкнутым в своем теле, продолжать общение с миром.Работы в этом направление успешно ведет не только Neurolink. Например, компания Synchron в этом году получила зеленый свет на испытания электрода, который позволит парализованным управлять своей жизнью через компьютер без операции на черепе — электрод будет доставляться через кровеносные сосуды, что значительно упрощает процедуру.
Например, компания Synchron в этом году получила зеленый свет на испытания электрода, который позволит парализованным управлять своей жизнью через компьютер без операции на черепе — электрод будет доставляться через кровеносные сосуды, что значительно упрощает процедуру.
Поскольку ввод данных является самым медленным этапом работы на компьютере, мгновенное управление своими гаджетами будет востребовано и вне клинических условий. Развитие нейрокомпьютерного интерфейса неминуемо приведет к созданию кибер средств для мониторинга состояния здоровья пациентов за пределами больницы. Но постепенно гаджеты нового типа попадут и на немедицинские рынки — для военных, полицейских, а позже и для широкой публики будут предложены чипы для усиления своей индивидуальности в метавселенных, для облегчения общения с друзьями и обмена данными с работодателем. Ведь кто откажется от возможности телепатического ввода текста на компьютере, заказа вина в ресторане силой мысли, или возможности распечатать на принтере картину своей мечты прямо из головы? Особенно, если для это уже не требуется делать трепанацию черепа.
Мнение редакции может не совпадать с точкой зрения автора
Список людей года по версии Nature «захватили» биологи и экологи
Журнал Nature опубликовал свой традиционный список людей года. По сравнению с предыдущими годами, в нем стало больше биологов и экологов. Не обошлось также без квантового превосходства, CRISPR-редактирования генома, «оживления» свиной головы и Греты Тунберг.
Каждый год журнал Nature завершает списком из 10 людей года — тех, кто особенно проявил себя в разных сферах науки. Среди них встречаются как ученые, которые совершают открытия, так и другие люди: политики, юристы, экологические активисты и даже пациенты — как, например, Эмили Уайтхед, которая попала в список 2017 года, потому что стала первым человеком, победившим рак с помощью генной терапии CAR-T.
В последние годы в десятке Nature оказывался один антигерой — человек, который сделал действительно много, но не в поддержку науки, а для борьбы с ней. В этот раз обошлось без антигероя, причем биологи и экологи всерьез потеснили физиков и общественных деятелей.
В этот раз обошлось без антигероя, причем биологи и экологи всерьез потеснили физиков и общественных деятелей.
Список открывает человек, который сам пострадал от антигероя — Рикардо Гальван (Ricardo Galvão). Это пожилой бразильский физик из Национального Института Космических Исследований случайно вошел в историю как борец за экологию и права ученых. Группа под его руководством опубликовала отчет об исчезновении лесов в долине Амазонки. Сама по себе эта проблема не нова, но в 2019 году ученые зафиксировали резкие изменения. Их отчет раскритиковал президент Бразилии, обвинив Гальвана в искажении данных и сговоре с защитниками окружающей среды. В ответ на это Гальван открыто назвал президента трусом, за что и лишился своей должности.
Еще один представитель фракции экологов в списке — Сандра Диаз (Sandra Díaz), сопредседатель Межправительственной группы экспертов по биоразнообразию и экосистемным услугам (IPBES). В частности, она координировала работу исследователей в 51 стране мира, результатом которой стал обзорный доклад по влиянию человека на биоразнообразие. На полутора тысячах страниц эксперты подробно рассказали о том, как оно менялось до сих пор, и предупредили, что около миллиона видов растений и животных могут исчезнуть с лица Земли в ближайшие десятилетия.
На полутора тысячах страниц эксперты подробно рассказали о том, как оно менялось до сих пор, и предупредили, что около миллиона видов растений и животных могут исчезнуть с лица Земли в ближайшие десятилетия.
В список также попали двое физиков. Первый — Виктория Каспи (Victoria Caspi), главный исследователь по поиску быстрых радиовсплесков в канадской коллаборации CHIME. До недавнего времени их было зафиксировано всего два, но в 2019 году команда Каспи обнаружила еще восемь — тем самым значительно увеличив количество информации об этих пока загадочных феноменах. Второй из физиков — Джон Мартинис, глава лаборатории Google, которая занимается квантовыми компьютерами. В конце октября его группа сообщила о том, что достигла квантового превосходства, то есть решила задачу, непосильную для современных суперкомпьютеров.
Каждый год Nature отмечает в своем списке людей, которые борются за соблюдение этических принципов в науке — например, гендерного равноправия или честности публикуемых данных. В этот раз таким человеком стала австралийский биоэтик Венди Роджерс (Wendy Rogers). С 2016 года она руководит консультативной группой при международной коалиции, которая призвана остановить нарушения закона при трансплантации органов в Китае — есть подозрения, что многие из этих органов получены от тюремных заключенных. Группа Роджерс внимательно анализировала статьи китайских врачей, связанные с трансплантацией. Сейчас около двух десятков таких работ отозваны из журналов — их авторы не смогли внятно объяснить происхождение донорских органов. А недавно группа Роджерс проанализировала отчет китайских властей о программе донорства и нашла в нем следы фальсификации данных.
В этот раз таким человеком стала австралийский биоэтик Венди Роджерс (Wendy Rogers). С 2016 года она руководит консультативной группой при международной коалиции, которая призвана остановить нарушения закона при трансплантации органов в Китае — есть подозрения, что многие из этих органов получены от тюремных заключенных. Группа Роджерс внимательно анализировала статьи китайских врачей, связанные с трансплантацией. Сейчас около двух десятков таких работ отозваны из журналов — их авторы не смогли внятно объяснить происхождение донорских органов. А недавно группа Роджерс проанализировала отчет китайских властей о программе донорства и нашла в нем следы фальсификации данных.
Также Nature отметил работы четырех биологов. Йоханнес Хайле-Селассие (Yohannes Haile-Selassie) обнаружил новый, неожиданно хорошо сохранившийся, череп анамского австралопитека. Этот череп относился к тому историческому периоду, по которому палеоантрополгам не хватало данных — 3,8 миллионов лет назад. Восполнив пробел в знаниях по этому периоду, Хейл-Селасси опроверг одно из предположений в области эволюции человека. Ранее считали, что афарские австралопитеки (к которым относится знаменитая Люси) произошли от анамских, однако новое открытие показало, что как минимум сотню тысяч лет два вида существовали параллельно.
Ранее считали, что афарские австралопитеки (к которым относится знаменитая Люси) произошли от анамских, однако новое открытие показало, что как минимум сотню тысяч лет два вида существовали параллельно.
Хункуй Дэн (Hongkui Deng) удостоился упоминания за то, что продемонстрировал безопасность
CRISPR-отредактированных клеток
для лечения ВИЧ-инфекции. Правда, эффективным его лечение не было — виной тому слишком низкий процент редактирования — однако главную свою цель, отсутствие побочных эффектов, он зафиксировал и создал полезный для клинической практики прецедент.
Не обошлось и без разговора о, вероятно, самом спорном эксперименте года — частичном восстановлении функций в мозге свиньи через четыре часа после смерти. СМИ называли его оживлением и воскрешением из мертвых и фантазировали о том, какие мысли могли бы появиться в таком мозге. Однако руководитель работы Ненад Сестан (Nenad Sestan) утверждает, что о каком бы то ни было воскрешении речи здесь не идет. Его группа просто показала способ поддерживать жизнеспособность нервных клеток в течение нескольких часов — что может быть полезно, например, при долгих операциях на мозге или клинической смерти.
Наконец, Жан-Жак Муембэ Тамфем (Jean-Jacques Muyembe Tamfum), один из первых исследователей эболавируса, сейчас отмечен Nature за заслуги в борьбе с эпидемией лихорадки Эбола в Конго. Муембе координирует не только работу по предотвращению распространения болезни, но и клинические испытания. В частности, благодаря ему мы знаем о том, что от лихорадки существуют эффективные лекарства, а в ноябре 2019 года была официально одобрена первая вакцина.
Завершает список Nature Грета Тунберг. Вслед за журналом Time, Nature оценил усилия, которые она приложила, чтобы привлечь внимание людей к проблеме изменения климата — в том числе, и молодых людей, которые вольются в научное сообщество в ближайшем будущем.
Вслед за основным списком Nature публикует небольшой постскриптум-тизер на 2020 год. В него входят те, кому еще только, возможно, предстоит внести свой вклад в мировую науку, кто балансирует на грани между рядовым исследованием (и, возможно, даже скандалом) и значительным открытием. Среди тех, за кем Nature призывает внимательно следить в будущем году, есть два человека, о которых мы уже рассказывали — это Гэн Мейюй, под руководством которой в Китае разработали новое (и вызывающее множество вопросов) лекарство от болезни Альцгеймера, и Денис Ребриков, российский биолог, который разрабатывает технологию генетического редактирования эмбрионов.
Среди тех, за кем Nature призывает внимательно следить в будущем году, есть два человека, о которых мы уже рассказывали — это Гэн Мейюй, под руководством которой в Китае разработали новое (и вызывающее множество вопросов) лекарство от болезни Альцгеймера, и Денис Ребриков, российский биолог, который разрабатывает технологию генетического редактирования эмбрионов.
Полина Лосева
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Освальд Эйвери – Биография, факты и фотографии
Жил в 1877 – 1955 гг.
Освальд Эйвери возглавлял группу, которая обнаружила, что ДНК передает инструкции по наследственности через последовательные поколения организмов – она несет химический код жизни.
Эйвери и его коллеги опубликовали свое открытие в классической статье, описывающей то, что стало известно как эксперимент Эйвери-Маклауда-Маккарти. На самом деле эксперимент представлял собой результаты более чем десятилетнего научного исследования.
Рекламные объявления
Начало
Освальд Теодор Эйвери родился в Галифаксе, Новая Шотландия, Канада, 21 октября 1877 года. Его британские родители, Джозеф Фрэнсис Эйвери и Элизабет Крауди, прибыли в Канаду четырьмя годами ранее.
Они эмигрировали, потому что Джозеф, баптистский служитель, почувствовал духовное призвание выполнять Божью работу в Северной Америке. Все трое сыновей пары родились в Канаде; Освальд был вторым сыном.
Семья переехала в Нью-Йорк, США, когда Освальду было 10 лет. Его отца пригласили стать пастором баптистской миссии Mariner’s Temple. Миссия находилась в нижнем Ист-Сайде Нью-Йорка, в перенаселенной части города с множеством социальных проблем — трудное место для взросления детей.
В свободное время Освальд и его старший брат Эрнест учились играть на корнете. С 12 лет Освальд и Эрнест исполняли музыку по воскресеньям за пределами миссии. Идея заключалась в том, чтобы заманить внутрь прохожих. Среди жителей района было много католиков и евреев, и отец Освальда стремился обратить их в баптистское вероисповедание.
Освальд был очень талантливым музыкантом. Позже ему была присуждена стипендия Национальной консерватории музыки, которой он не воспользовался.
В возрасте 15 лет Освальд перенес два потрясения: первое — смерть его брата Эрнеста, скорее всего, от туберкулеза; затем смерть отца от болезни почек.
Никаких наук в колледже
В 1893 году, незадолго до достижения 16-летнего возраста, Освальд Эйвери получил диплом мужской гимназии Нью-Йорка и поступил в Академию Колгейт.
В 1896 году он поступил на первый курс Нью-Йоркского университета Колгейт, где снова проявился его музыкальный талант, и он стал лидером оркестра колледжа.
Он специализировался на гуманитарных науках, в последние годы набирая в среднем более 9 баллов из 10. Он получил степень бакалавра гуманитарных наук в июне 1900 года в возрасте 22 лет. Он посещал научные курсы только тогда, когда они были обязательными.
Курсы, которые он выбрал на последнем курсе, включали философию, английскую литературу, политическую экономию, ораторское искусство и историю искусства.
Медицинская школа
К осени 1900 года представления Эйвери о своем будущем резко изменились: он поступил в медицинскую школу — Колледж врачей и хирургов Колумбийского университета в Нью-Йорке.
Он продолжал получать хорошие оценки в Колумбийском университете, за одним ироничным исключением. Человек, который впоследствии стал всемирно известным бактериологом, получил худшие оценки по курсу бактериологии.
В 1904 году, в возрасте 26 лет, Эйвери закончила учебу и занялась общей медицинской практикой.
Введение в бактериологию
После двух лет работы семейным врачом Эйвери надоело. Слишком многие из его пациентов страдали от неизлечимых заболеваний, из-за чего он чувствовал себя совершенно беспомощным.
Он пришел к выводу, что лучший способ помочь обществу — это найти способы не дать микроорганизмам убивать людей. Он решил стать микробиологом.
Он перешел на другую работу постепенно, работая неполный рабочий день в области бактериологии молока – его работа заключалась в измерении количества бактерий в молоке до и после пастеризации.
Исследование пневмонии
В 1907 году в возрасте 30 лет Эйвери стал заместителем директора лаборатории Хогланда в Бруклине, Нью-Йорк. Там, помимо обучения студентов, он обучал современным химическим и бактериологическим методам. Он также научился проводить эксперименты с необычайно тщательной тщательностью – это будет одной из характеристик его будущей исследовательской работы.
Он начал свою исследовательскую карьеру с изучения кисломолочных продуктов, таких как йогурт. Он исследовал их роль в борьбе с вредными кишечными бактериями у людей — тема, которая снова стала модной примерно 100 лет спустя.
Изображение бактерий Lactobacillus plantarum, распространенных в ферментированных пищевых продуктах. Считается, что присутствие таких бактерий в кишечнике человека улучшает наше здоровье.
Эйвери опубликовал девять статей в академических журналах. В 1913 году статья, которую он написал о туберкулезе, привлекла внимание Руфуса Коула, директора Рокфеллеровского института на Манхэттене. Во время визита в Хоугленд Коул поговорил с Эйвери, чтобы оценить его.
Во время визита в Хоугленд Коул поговорил с Эйвери, чтобы оценить его.
В результате Эйвери стал бактериологом в Рокфеллеровском институте в сентябре 1913 года, за месяц до своего тридцать шестого дня рождения.
До конца своей карьеры Эйвери сосредоточил свои исследования на бактериях пневмонии. До антибиотиков пенициллинового ряда оставалось еще несколько десятилетий, а ежегодно от пневмонии умирало более 50 тысяч человек в Америке.
Странный способ стать американцем
Америка вступила в Первую мировую войну в 1917 году. Эйвери пытался вступить в медицинский корпус армии США в качестве офицера. Ему было отказано, потому что, хотя он и прожил всю свою сознательную жизнь в Америке, а фактически более 30 лет, он не был ее гражданином.
Эйвери, 40 лет, выдающийся бактериолог, зачислен рядовым — низший чин. Затем, поскольку он находился на действительной службе в военное время, он был натурализован как гражданин США. В 1918 году он был произведен в капитаны медицинской службы.
Наследственность и ДНК до Эйвери
Мендель, Мишер и ДНК
В 1866 году Грегор Мендель, работая в Моравии (ныне Чехия), показал, что потомство наследуют физические характеристики своих родителей в соответствии с четкими математическими правилами. Его работа игнорировалась до 1900.
В 1871 году Фридрих Мишер в Германии открыл новое вещество, назвав его нуклеином , потому что оно происходило из ядра клетки. Сегодня мы называем это вещество дезоксирибонуклеиновой кислотой или, проще говоря, ДНК.
Ученые на самом деле не подозревали, что ДНК играет роль в наследственности. Они знали, что что-то должно передавать инструкции от родителей потомству, и они знали, что инструкции подчиняются законам Менделя. Эти инструкции — единицы наследственности — получили название генов.
Никто не знал, из чего состоят гены, но долгое время считалось, что они основаны на белках.
Эксперимент Гриффита. Жизнь становится странной
В 1928 году Фредерик Гриффит из Великобритании обнаружил нечто удивительное – он превратил один штамм бактерий в другой.
В его работе участвовал Streptococcus pneumoniae , вид, имеющий два штамма — шероховатый (R) и гладкий (S), названный так из-за их внешнего вида под микроскопом.
Мультяшное изображение Streptococcus pneumoniae шероховатые и гладкие штаммы.
Грубый не особо вреден. Гладкий — убийца.
Гриффит экспериментировал, заражая мышей бактериями R и S. Он нашел:
- Мыши, зараженные R, выжили — как и ожидалось.
- мышей, инфицированных S, умерли – как и ожидалось.
- мышей, зараженных умерщвленным нагреванием S, выжили – как и ожидалось.
- Мыши, инфицированные смесью R и умерщвленные нагреванием S, умерли – НЕ ожидалось. Более того, живые S были обнаружены в телах мышей, зараженных смесью R и умерщвленных нагреванием S – НЕ ожидалось.
Что-то из мертвого S побудило живое R произвести живое S. И, что очень важно, изменение было наследственным: когда R превратилось в S, следующие поколения бактерий были S.
После Эйвери
От скептицизма to Вера
Работа Гриффита заинтересовала Эйвери. Это было связано с его собственной специальностью – бактериями пневмонии. Эйвери восхищался Гриффитом, но с недоверием встретил его выдающиеся результаты, подозревая, что бактерии заражены.
Молодой научный сотрудник лаборатории Эйвери, Мартин Доусон, повторил работу Гриффита. Когда Доусон подтвердил результаты Гриффита, Эйвери был вынужден признать, что преобразование R в S было фактом. К такому же выводу пришли и другие лаборатории.
Мыши не нужны
Доусон продолжил исследование странного явления. В 1930 году он добился значительного прогресса, доказав, что мыши были невинными наблюдателями. Он смешал R и убитые нагреванием бактерии S в стеклянной посуде и увидел, как R размножается, чтобы произвести S.
Первое выделение ДНК
Доусон перешел на новую работу, и Эйвери увлек другого молодого исследователя из Рокфеллера, Джеймса Аллоуэя, начать работу над тем, что он назвал принципом преобразования .
Alloway растворил убитые нагреванием S-клетки и отфильтровал их фрагменты, чтобы оставить волокнистое вещество. Теперь мы знаем, что это была ДНК, а Аллоуэй — нет. Он обнаружил, что этого вещества было достаточно, чтобы преобразовать R в S. В 1932 году Аллоуэй перешел на новую работу.
Белое вещество представляет собой ДНК, извлеченную из ядер клеток.
Доусон и Аллоуэй предложили теории о принципе преобразования, ни одна из которых не оказалась верной.
Медленная, трудная работа
Эйвери начал проводить эксперименты сам, но его время было сильно ограничено работой над другими крупными исследованиями. Он также провел около шести месяцев вдали от лаборатории в тяжелом состоянии.
Эксперименты были сложными, часто давали результаты, которые невозможно было повторить. Прогресс был очень медленным.
К 1935 году Эйвери показал, что ни белки, ни углеводы не вызывают трансформацию. Возможно, он предположил в 1936, нуклеиновая кислота была ключевым фактором? Конечно, нуклеиновых кислот всего две, ДНК и РНК, так что Эйвери был близок к ответу. Однако пройдет еще много лет, прежде чем он почувствует, что у него есть доказательства своих предположений.
Однако пройдет еще много лет, прежде чем он почувствует, что у него есть доказательства своих предположений.
Становимся быстрее – белки и липиды исключены
В 1935 году к Эйвери присоединился новый молодой исследователь, Колин Маклауд, вундеркинд, который был принят в Университет Макгилла в Монреале в возрасте 15 лет.
Маклауд и Эйвери необычно похожее происхождение: каждый из них был уроженцем Новой Шотландии, и каждый переехал в Нью-Йорк. Оба они были квалифицированными врачами, сменившими карьеру на бактериологию. Их отцы оба были служителями протестантской церкви, и оба переехали в Канаду из Великобритании.
Маклауд придал исследованиям новый импульс, разработав более надежные лабораторные методы. Однако и Эйвери, и Маклауд участвовали и в других проектах.
В 1940 году они бросили всю другую работу, чтобы сконцентрироваться на принципе преобразования, работая вместе долгие часы в лаборатории.
К 1941 году Эйвери и Маклауд были уверены, что трансформирующий принцип не содержит белков и липидов. Они знали это, потому что могли надежно удалить эти вещества из убитых нагреванием S-бактерий и увидеть, что то, что осталось, вызвало переход R в S.
Они знали это, потому что могли надежно удалить эти вещества из убитых нагреванием S-бактерий и увидеть, что то, что осталось, вызвало переход R в S.
На этом этапе Маклауд официально покинул проект; он был назначен профессором бактериологии в Медицинской школе Нью-Йоркского университета. На практике, однако, он часто возвращался, когда проект приближался к своему захватывающему завершению.
ДНК Smooth превращает Rough в Smooth
После официального ухода Маклауда к проекту в сентябре 1941 года присоединился Маклин Маккарти, 30-летний докторант из Индианы. Маккарти проводил исследования в больнице Джона Хопкинса. Когда его босс там, профессор Эдвардс Парк, услышал, что Маккарти собирается присоединиться к лаборатории Эйвери, он сказал Маккарти, что Эйвери находится на вершине стратосферы для исследований.
Теперь прогресс был быстрым. Ученые удалили все остальные части клетки, оставив только трансформирующее вещество. Маккарти путем химических испытаний установил, что это вещество могло быть только дезоксирибонуклеиновой кислотой, то есть ДНК. Эйвери отметил, что ДНК этих бактерий раньше даже не находили.
Эйвери отметил, что ДНК этих бактерий раньше даже не находили.
Avery-MacLeod-McCarty
Ближе к концу 1943 года Avery, MacLeod и McCarty представили свою работу для публикации в Journal of Experimental Medicine . Он был опубликован в следующем году.
Они обнаружили, что ДНК является генетическим материалом. Он вызывает наследственные изменения у бактерий. Он имеет очень высокую молекулярную массу и поэтому представляет собой огромную молекулу. Их работа стала известна как эксперимент Эйвери-Маклауда-Маккарти.
«Публикация Эйвери, Маклауда и Маккарти всего 50 лет назад ознаменовала начало современной эры генетики, ее молекулярной фазы».
Джошуа Ледерберг, 1994 г.
Микробиолог, лауреат Нобелевской премии по медицине, 1958 г.
Гены — это ДНК
По иронии судьбы работа Эйвери была завершена, когда бушевала Вторая мировая война. Он и его коллеги открыли один из секретов жизни в то время, когда больше ученых, чем когда-либо, искали эффективные способы доставки смерти.
Эйвери было 66 лет, когда его работа по ДНК была наконец опубликована.
Идея о том, что гены представляют собой ДНК, встретила сильное сопротивление. Ряд влиятельных ученых не отказывались от идеи, что гены — это белки. Они объяснили результаты Эйвери тем, что его ДНК была загрязнена белками. Однако со временем никто не смог опровергнуть новый статус ДНК.
Эдвин Чаргафф был одним из немногих ученых, быстро воспринявших работу Эйвери, и именно он сделал следующие большие шаги к пониманию роли ДНК в генетике.
К 1953 году Джеймс Уотсон и Фрэнсис Крик открыли структуру ДНК и то, как она воспроизводится. Эйвери прожила достаточно долго, чтобы увидеть это.
Теперь ученые точно знают, что ДНК содержит инструкции, необходимые для сборки безжизненных молекул в живые организмы.
«…открытие того, что ДНК может передавать генетическую информацию от одного пневмококка к другому… ознаменовало открытие области молекулярной биологии…»
Фрэнк Макфарлейн Бернет, «Изменение закономерностей», 1968 г.
Вирусолог, лауреат Нобелевской премии по медицине 1960 г.
Нет Нобелевской премии
Эйвери никогда не был удостоен Нобелевской премии. Его часто номинировали за работу над антигенами, которую он проделал в 1930-х годах. Он также был номинирован за свою работу с ДНК. Номинации не увенчались успехом.
В 1945 году Британское королевское общество наградило Эйвери престижной медалью Копли, а в 1947 году он получил главную награду Америки в области медицины — премию Ласкера.
«Эксперимент Эйвери заставил ее [ДНК] пахнуть как основной генетический материал».
Джеймс Д. Уотсон, Двойная спираль, 1968
Генетик, Нобелевская премия по медицине 1962
Некоторые личные данные и конец
Эйвери жил в основном своей работой. Он никогда не был женат и не имел детей. Он никогда не терял любви к музыке, а в отпуске любил проводить время под парусом.
Он был известным оратором и участником дебатов в колледже, но в своей профессиональной жизни он обычно неохотно выступал перед публикой. На самом деле ему было по-настоящему непринужденно только в своей лаборатории, в компании своих исследователей. Все называли его «Фесс» — сокращение от «Профессор».
На самом деле ему было по-настоящему непринужденно только в своей лаборатории, в компании своих исследователей. Все называли его «Фесс» — сокращение от «Профессор».
В 1948 году в возрасте 71 года Эйвери переехала в Нэшвилл, штат Теннесси, чтобы насладиться семейной жизнью. Он снял большой дом недалеко от дома своего младшего брата Роя, который преподавал бактериологию в Университете Вандербильта. Эйвери проводила много времени с семьей Роя. Его двоюродная сестра Минни Ванделл стала его экономкой.
Освальд Теодор Эйвери умер в возрасте 78 лет 20 февраля 1955 года в Нэшвилле от рака печени. Он был похоронен на кладбище Маунт-Оливет в Нэшвилле.
Объявления
Автор этой страницы: The Doc
Изображения, обработанные в цифровом виде и раскрашенные на этом веб-сайте. © Все права защищены.
Цитировать эту страницу
Пожалуйста, используйте следующую ссылку в соответствии с MLA:
«Освальд Эйвери». Известные ученые.Сайт известных ученых. 20 июля 2016 г. Интернет.
.
Опубликовано FamousScientists.org
Дополнительная литература
Освальд Т. Эйвери, Колин М. Маклауд, Маклин Маккарти
Исследования химической природы вещества, вызывающего трансформацию пневмококковых типов – индукция трансформации фракцией дезоксирибонуклеиновой кислоты, выделенной из пневмококка типа III
Journal of Experimental Medicine Vol. 79, № 2, стр. 137–158, 1943
Рене Жюль Дюбо
Профессор, Институт и ДНК
Рокфеллеровский университет. Press, 1976
Гораций Фриланд Джадсон
Восьмой день творения: создатели революции в биологии
Саймон и Шустер, 19 лет79
Маклин Маккарти
Принцип трансформации
W.W. Norton & Company, 1986
Джошуа Ледерберг
Трансформация генетики с помощью ДНК
Genetics Vol. 136, стр. 423-426, февраль 1994 г.
Благодарности
Изображение ДНК в колбе в Берлинском музее естественной истории, сделанное LoKiLeCh под лицензией Creative Commons Attribution 3. 0 Unported.
0 Unported.
Изображение Фрэнка Макфарлейна Бернета, сделанное Денвером Файнголдом в соответствии с лицензией Creative Commons Attribution 4.0 International.
Линда Бак – биография, факты и фотографии
Родилась в 1947 году.
Линда Бак получила Нобелевскую премию по физиологии и медицине 2004 года вместе со своим коллегой Ричардом Акселем за открытие деталей того, как работает наше обоняние. Она получила степень и аспирантуру позже, чем большинство, потратив время на то, чтобы найти дело, которое действительно вдохновило ее.
Достижения и ключевые моменты
До того, как Бак и Аксель выполнили свою работу:
- Исследователи запахов знали, что крошечные изменения в молекулах, обнаруживаемые нашим обонянием, могут вызвать большие изменения в интерпретации запаха нашим мозгом.
- Джордж Уолд, среди прочих, обнаружил, что только три типа рецепторов света позволяют нам различать очень большое количество цветов.
 Ситуация с запахами была неизвестна.
Ситуация с запахами была неизвестна.
Бак и Аксель хотели узнать:
- Как наш мозг различает тысячи различных запахов, от банановых кексов до гнилой капусты. Работал ли он как цвет, когда небольшое количество рецепторов взаимодействовало с большим количеством различных молекул запаха? Или каждый из большого числа рецепторов идентифицировал небольшое количество различных молекул запаха?
- Как наш организм преобразует запахи в информацию, которую нервные клетки передают в наш мозг.
Бак и Аксель открыли:
- У людей есть около 350 различных типов обонятельных рецепторов – эти рецепторы находятся на нервных клетках в верхней части носа.
- Каждая клетка в верхней части носа имеет только один тип рецепторов.
- Каждый рецептор запаха является узкоспециализированным и может обнаруживать лишь небольшое количество различных молекул запаха.
- Каждый тип рецептора запаха представляет собой отдельную белковую молекулу.

- Каждый рецептор запаха (молекула белка) изменяется, когда к нему присоединяется молекула запаха, посылая электрический сигнал через нервные клетки в мозг.
- Рецепторные клетки посылают сигналы непосредственно в обонятельную луковицу мозга — часть мозга, отвечающую за наше обоняние.
- Существует большое семейство генов, насчитывающее до 1000 генов, которые контролируют производство специализированных белковых рецепторов запаха.
Позже Бак обнаружил, что:
- Отдельный запах, распознаваемый нашим мозгом, например яблочный пирог, обычно состоит из множества различных молекул запаха. Эти отдельные молекулы распознаются разными рецепторами запаха. Наш мозг распознает яблочный пирог, используя сообщения, посылаемые комбинациями рецепторов, например, определенные наборы чисел формируют комбинацию для открытия сейфа.
«До занятий Акселя и Бака обоняние было загадкой».
Профессор Стен Гриллнер, 2004
Реклама
Начало и школа
Линда Браун Бак родилась 29 января 1947 года в Сиэтле, штат Вашингтон, США. Ее отец был инженером-электриком, мать – домохозяйкой: Линда была второй из трех дочерей.
Ее отец был инженером-электриком, мать – домохозяйкой: Линда была второй из трех дочерей.
Получив образование в старшей школе Рузвельта в Сиэтле, учительница записала в ежегоднике, что Линда может стать «великим биологом однажды».
«Вы могли подумать, что я странный ребенок из-за того, что я делал. Я похоронил своего хомяка после того, как он умер, а через некоторое время выкопал его, чтобы посмотреть, как он выглядит. Мне всегда было любопытно».
Линда Бак, 2004 г.
15 лет для B.S. и доктор философии
Бак окончил среднюю школу Рузвельта в 1965 году в возрасте 18 лет и провел следующие 10 лет с перерывами в Вашингтонском университете в Сиэтле, который окончил в 1975 году в возрасте 28 лет со степенью бакалавра психологии и микробиологии.
О том, сколько времени ушло на получение первой степени, Бак прокомментировала:
«Я не была уверена, чем хочу заниматься. Я был полон тоски; Я хотел сделать что-то, чтобы помочь другим людям, но я не хотел становиться доктором медицины. Потом я открыл для себя иммунологию и никогда не оглядывался назад».
Я был полон тоски; Я хотел сделать что-то, чтобы помочь другим людям, но я не хотел становиться доктором медицины. Потом я открыл для себя иммунологию и никогда не оглядывался назад».
Линда Бак, 2004 г.
Следующие несколько лет Бак провел, работая с профессором Эллен Витетта в Юго-западном медицинском центре Техасского университета в Далласе, в результате чего ему была присуждена степень доктора философии. Бак получил степень бакалавра иммунологии в 1980 году.
Исследовательские должности и исследования, получившие Нобелевскую премию
Бак провел два года, занимаясь постдокторскими исследованиями в Колумбийском университете в Нью-Йорке, а в 1982 году присоединился к исследовательской группе доктора Ричарда Акселя в Колумбийском университете. В 1984 году она стала сотрудником лаборатории Акселя.
В 1985 году Бак прочитал статью выдающегося нейробиолога Соломона Снайдера и его группы о белке, обнаруживающем запах. Статья пробудила в ней энтузиазм по поводу разгадки загадки того, как мы пахнем.
В 1988 году она начала искать гены, кодирующие рецепторы молекул запаха. Работа, которую они с Акселем написали в 1991 году и которая привела к Нобелевской премии, стала кульминацией трехлетней работы с абсолютной самоотдачей по 12-15 часов в день над проектом, уходя домой только для сна. Газета называлась Новое семейство мультигенов может кодировать рецепторы запахов: молекулярная основа распознавания запахов .
«Я никогда не был близок к тому, чтобы сдаться. Я был очень оптимистичен. Если один подход не срабатывал, я думал о другом. Я просто продолжал двигаться вперед… Самое важное, что я говорю начинающим молодым ученым, — это выбрать для работы проблему, которая их увлекает. Тогда им понравится то, что они делают, и они смогут справиться с трудностями, не разочаровываясь».
Линда Бак, 2014
Почетный доктор. Университет Бен-Гуриона
В 1995 году она стала доцентом Гарвардской медицинской школы в Бостоне.
«Я был благодарен, что Ричард [Аксель] был терпим к моим рискованным начинаниям. Он был необычным наставником в том смысле, что давал людям в своей лаборатории широкую независимость в прокладывании собственного курса после того, как они зарекомендовали себя».
Линда Бак, 2004
«Линда Бак разработала творческий подход, который действительно идентифицировал гены, кодирующие рецепторы, распознающие широкий спектр запахов в окружающей среде».
Ричард Аксель, 2004 г.
В 2001 году Бак стал профессором Гарварда. В 2002 году она вернулась в свой родной город Сиэтл в Центр исследования рака Фреда Хатчинсона.
Награды
- 1992: Премия Такасаго за исследования в области обоняния
- 1992: Премия LVMH Moet Hennessy Louis Vuitton «Наука за искусство»
- 1992: Премия «Чувство запаха», Fragrance Foundation
- 1996: Научная премия Unilever
- 1996: Премия Р.
 Х. Райта в области обонятельных исследований
Х. Райта в области обонятельных исследований - 1996: Премия Льюиса С. Розенстиля за выдающуюся работу в области фундаментальных медицинских исследований
- 2002: Премия Perl / UNC в области неврологии
- 2003: Международная премия Фонда Гэрднера
- 2004: Нобелевская премия по физиологии и медицине .
Личные данные
Бак вышла замуж за биолога Роджера Брента в 2006 году.
Процитировать Страница
Пожалуйста, используйте следующую ссылку в соответствии с MLA:
«Линда Бак». Известные ученые. Сайт известных ученых. 28 марта 2018 г. Интернет..
Опубликовано FamousScientists.org
Дополнительная литература
Линда Бак и Ричард Аксель
Новое мультигенное семейство может кодировать рецепторы запаха: молекулярная основа распознавания запаха.
Сотовый. 65(1): стр. 175-87. 5 апреля 1991
Линда Бак
Новое семейство мультигенов может кодировать рецепторы запаха.

 Сайт известных ученых. 20 июля 2016 г. Интернет.
Сайт известных ученых. 20 июля 2016 г. Интернет.
 Ситуация с запахами была неизвестна.
Ситуация с запахами была неизвестна.
 Х. Райта в области обонятельных исследований
Х. Райта в области обонятельных исследований